【FluidicLab客户论文导读】2025年8月9日,深圳大学第一附属医院、南方科技大学第二附属医院的陈实、张政、王连荣教授合作在Nature Communications上发表了题为“A multivalent mRNA vaccine elicits robust immune responses and confers protection in a murine model of monkeypox virus infection”的研究论文。该文章报道了两种新的猴痘病毒多价mRNA-LNP候选疫苗,并系统地研究了疫苗接种后产生的细胞和体液免疫反应。通过单细胞转录组测序解析了TCR和BCR库的详细信息,在单细胞分辨率上加深了对抗病毒机制的理解。
LNP-mRNAs合成
文中,LNP-mRNA疫苗的制备使用了上海澎赞生物公司的FluidicLab智能纳米颗粒合成仪(FluidicLab NP-S2)进行合成。
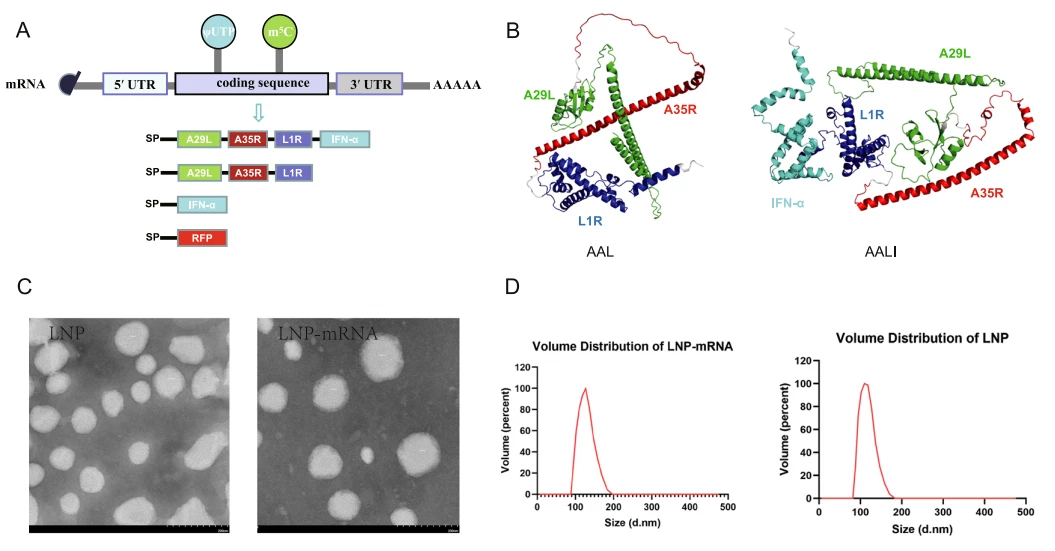
制备的两种猴痘疫苗AAL和AALI,其具有编码猴痘病毒A35R、A29L和L1R蛋白的mRNA核酸序列。其中AALI疫苗中额外含有一段编码IFN-α干扰素的mRNA。这些核酸序列被包裹在由甘露糖修饰的脂质纳米颗粒中。这使得它们能够被靶向释放至体内的巨噬细胞和树突状细胞中。
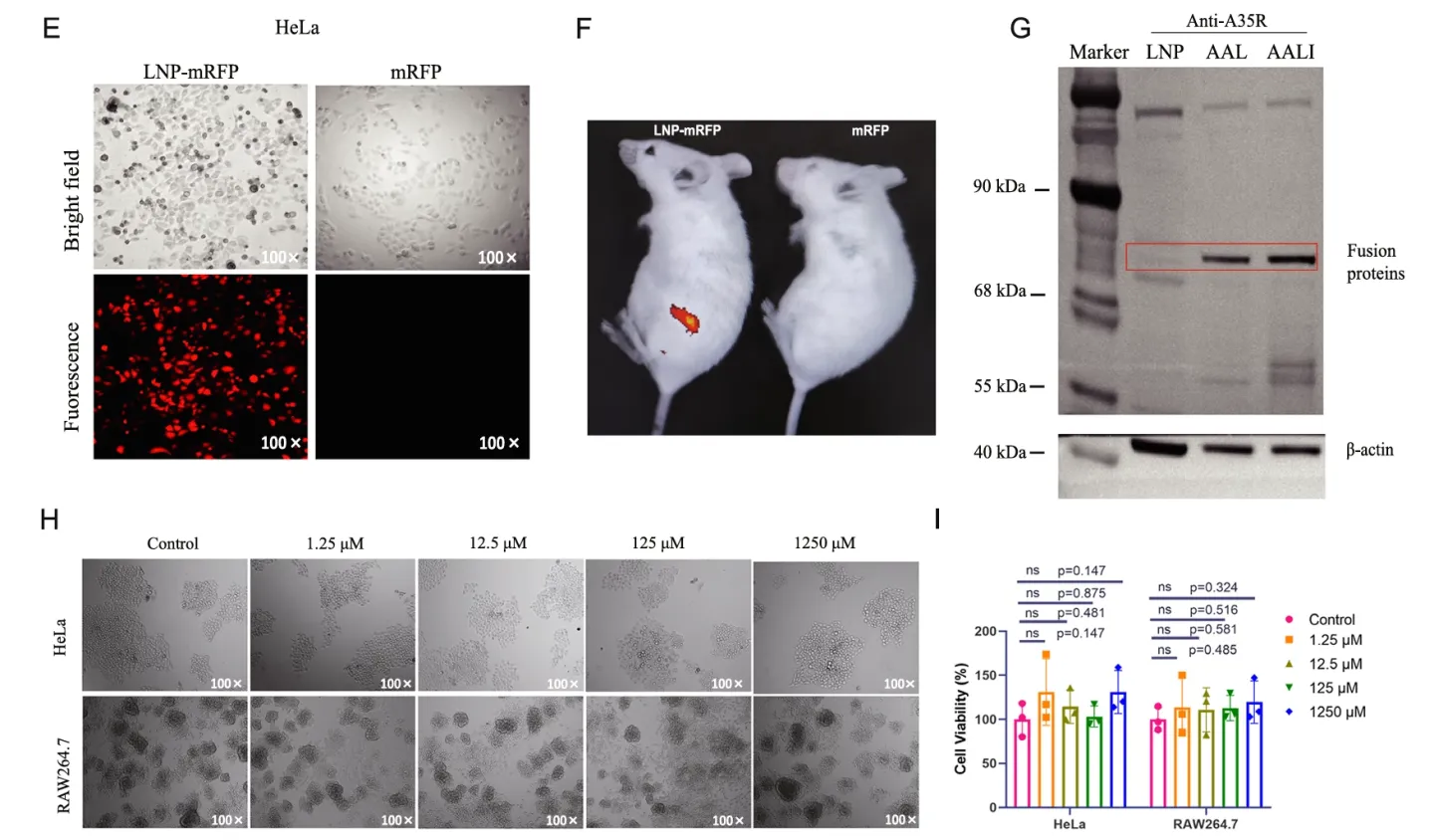
作者用透射电镜和动态光散射仪分别检测了纳米颗粒的表观特征。结果显示使用NP-S2制备的LNP均具有良好的圆度,测量的粒径分布在100-120nm且多分散指数(PDI)较低。转染后的荧光电镜和Western试验表明了mRNA-LNP的脂质纳米颗粒疫苗成功、高效地将目的核酸片段递送至了细胞和小鼠体内。细胞活性测试、小鼠实验也证明了该疫苗的安全性,无明显细胞毒性和组织损伤(Fig.1)。
Fig.1
免疫响应检测
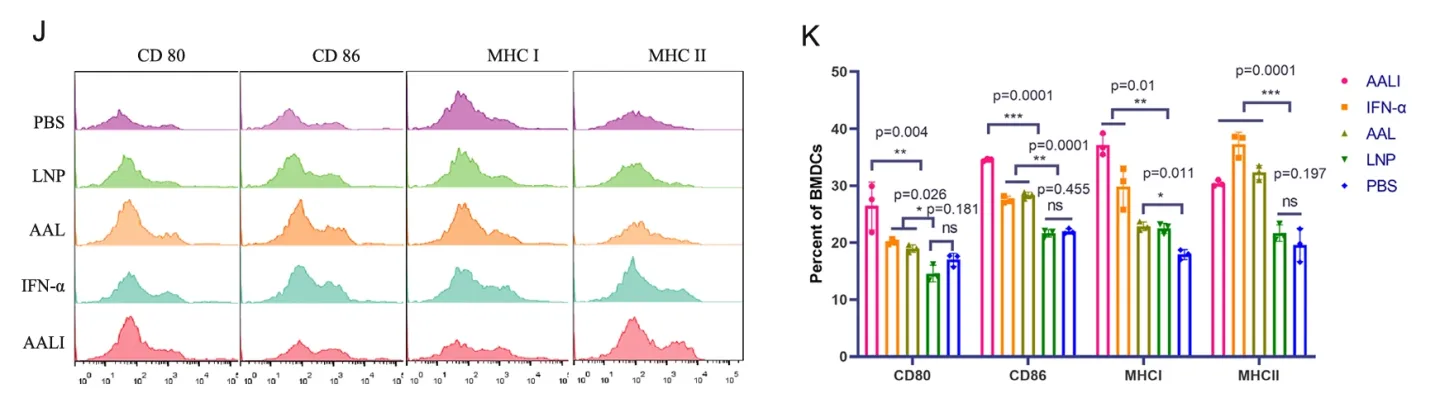
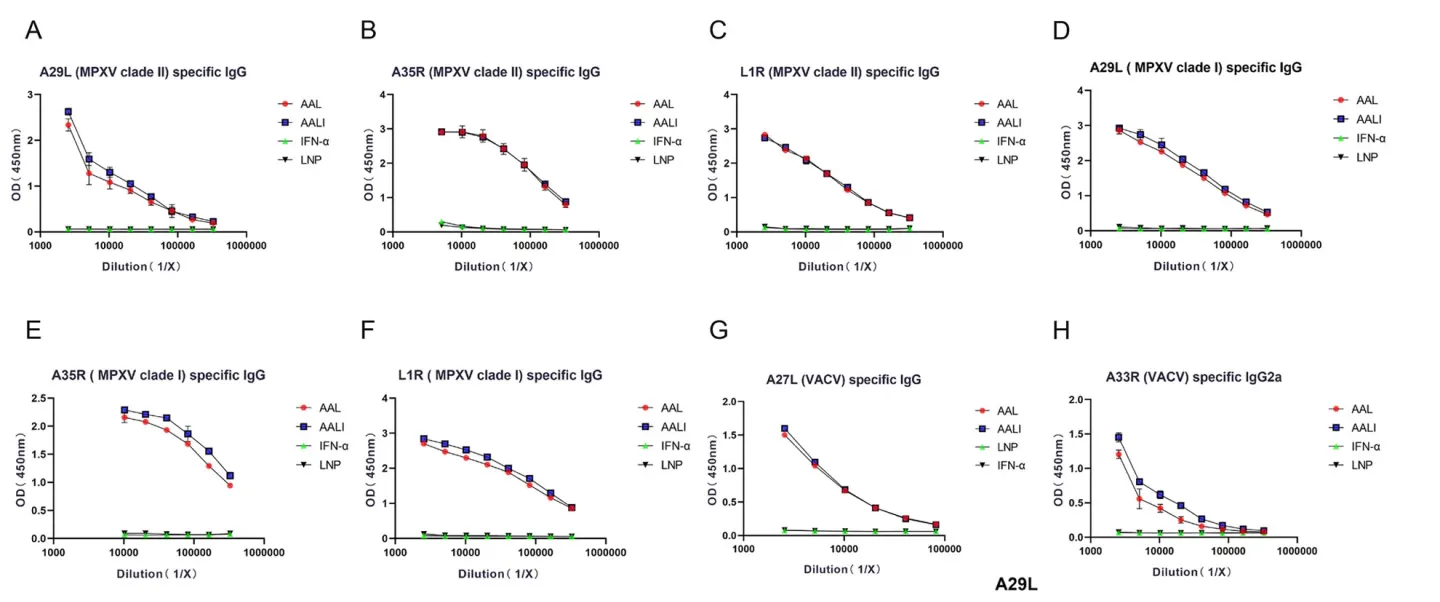
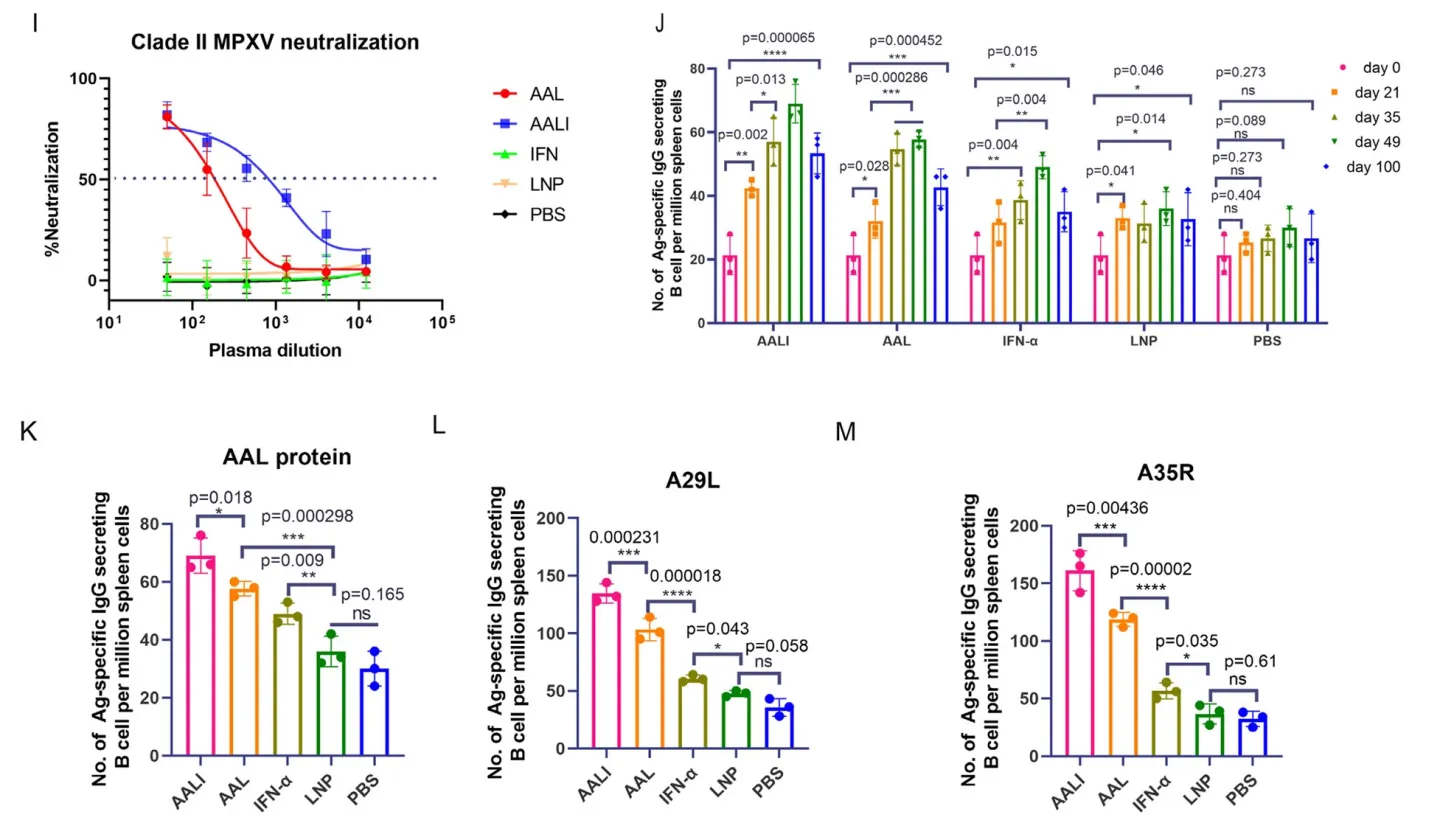
后续的研究发现,疫苗处理组能够引发强烈的免疫反应,三次注射疫苗后100天,仍有较高浆细胞水平。证明该疫苗能够成功诱导记忆B细胞的产生,具有提供长期免疫的可能。产生的抗体对病毒具有高亲和性。该两种疫苗还表现出对牛痘病毒的抗原蛋白的特异抗性,说明痘病毒之间的核酸序列具有保守性,为后续的交叉抗性疫苗开发提供了支持。疫苗也可显著诱导小鼠中CD4+细胞和CD8+细胞的增殖。T细胞内促炎和IFN-γ应答通路被激活(Fig.2)。
Fig.2
疫苗对于小鼠的保护效力检测
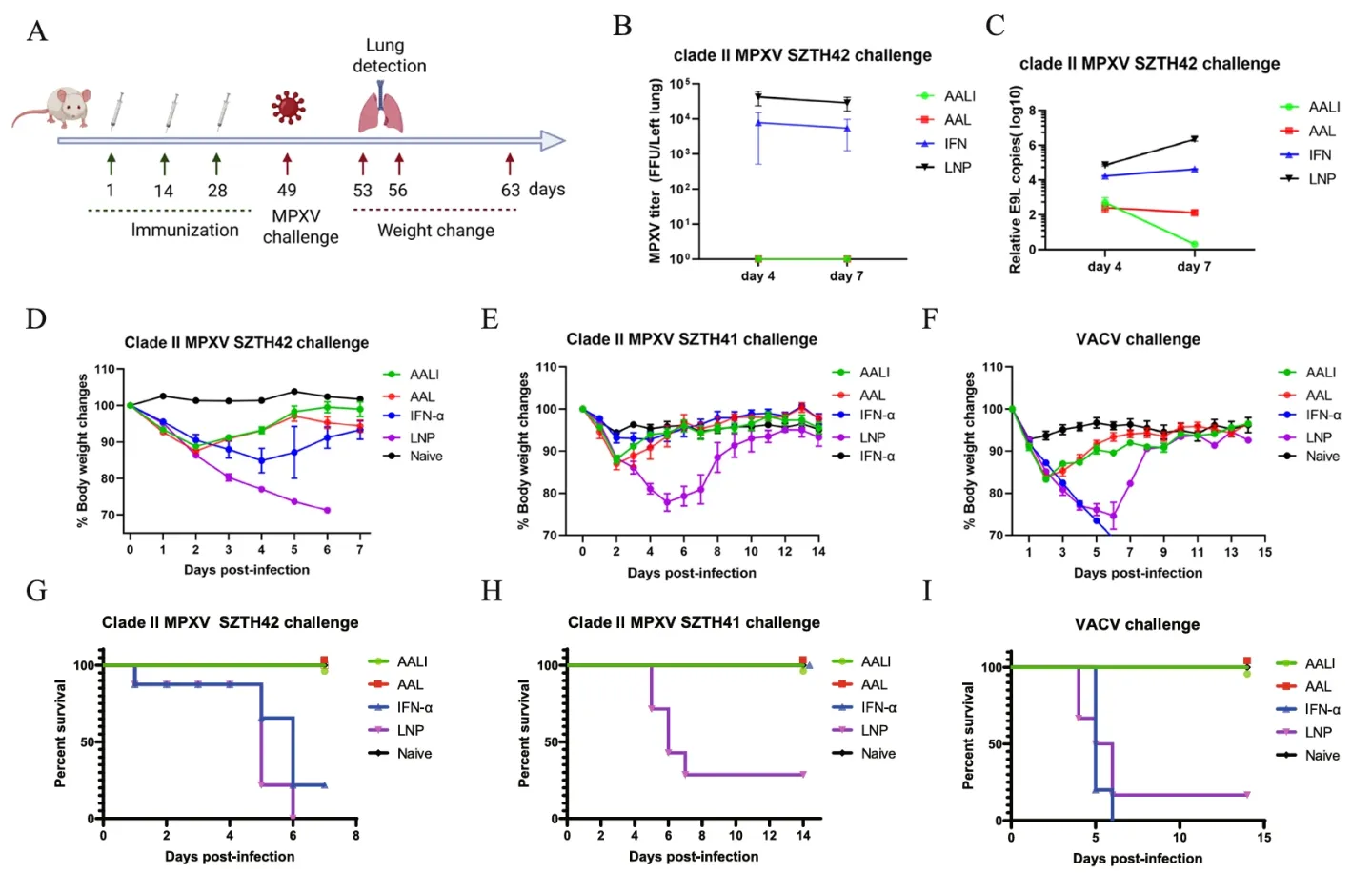
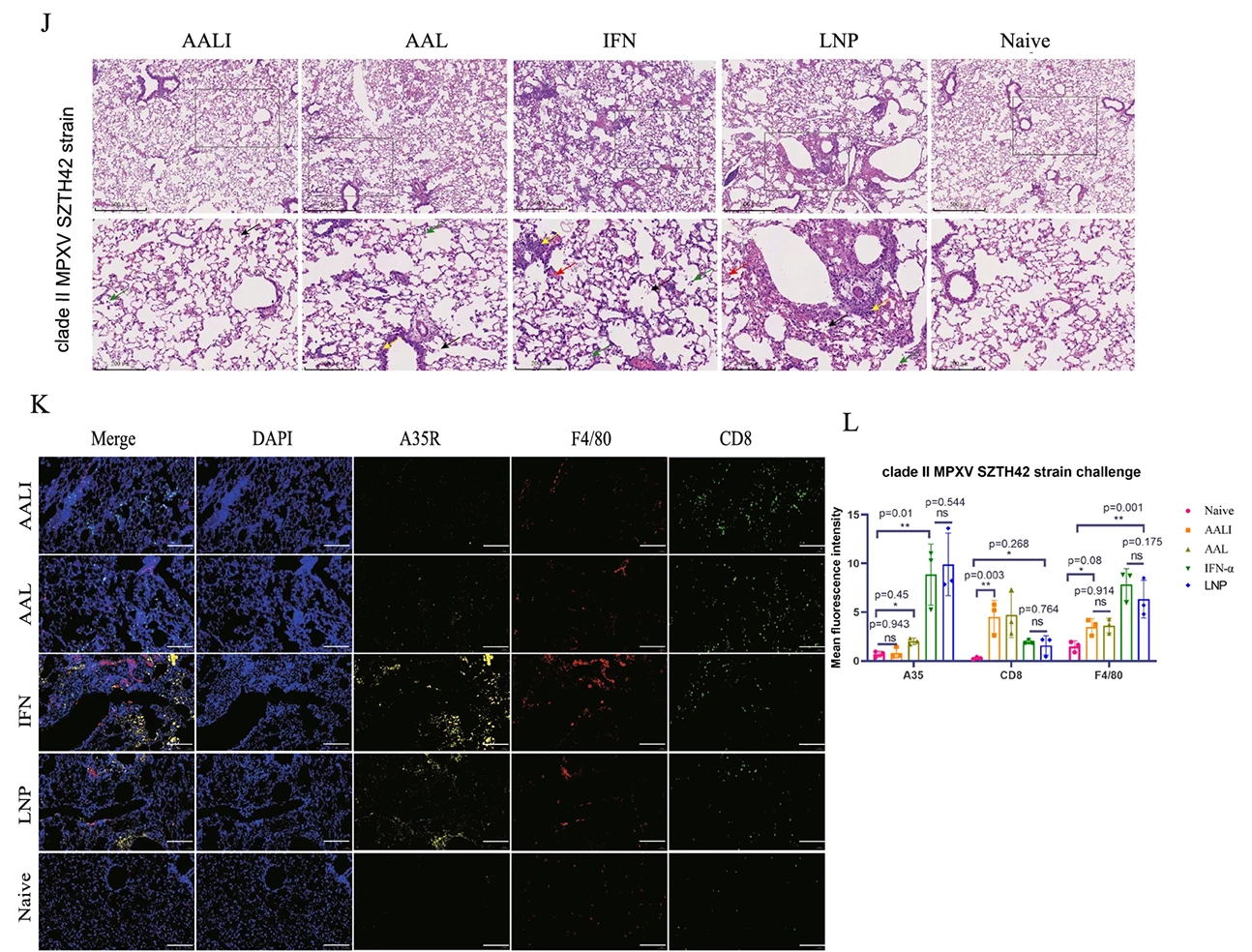
为了验证mRNA-LNP疫苗的保护效果,在第三次免疫的三周后,通过鼻腔接种使小鼠感染不同毒株。并在感染4天、7天采集肺部样本进行检测。qPCR结果显示接种疫苗的小鼠病毒载量小。小鼠的体重恢复率与存活率显著更高。这些实验结果都证明了AAL/AALI疫苗能够有效提高小鼠对于猴痘、牛痘病毒的抗性,保护小鼠(Fig.4)。
Fig.4
NGS分析
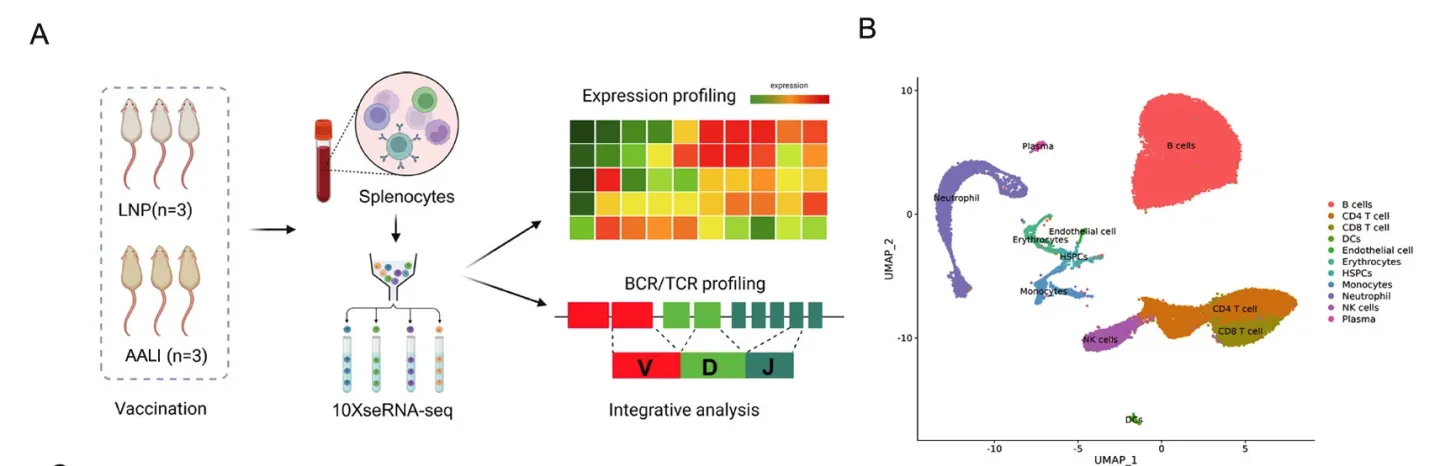
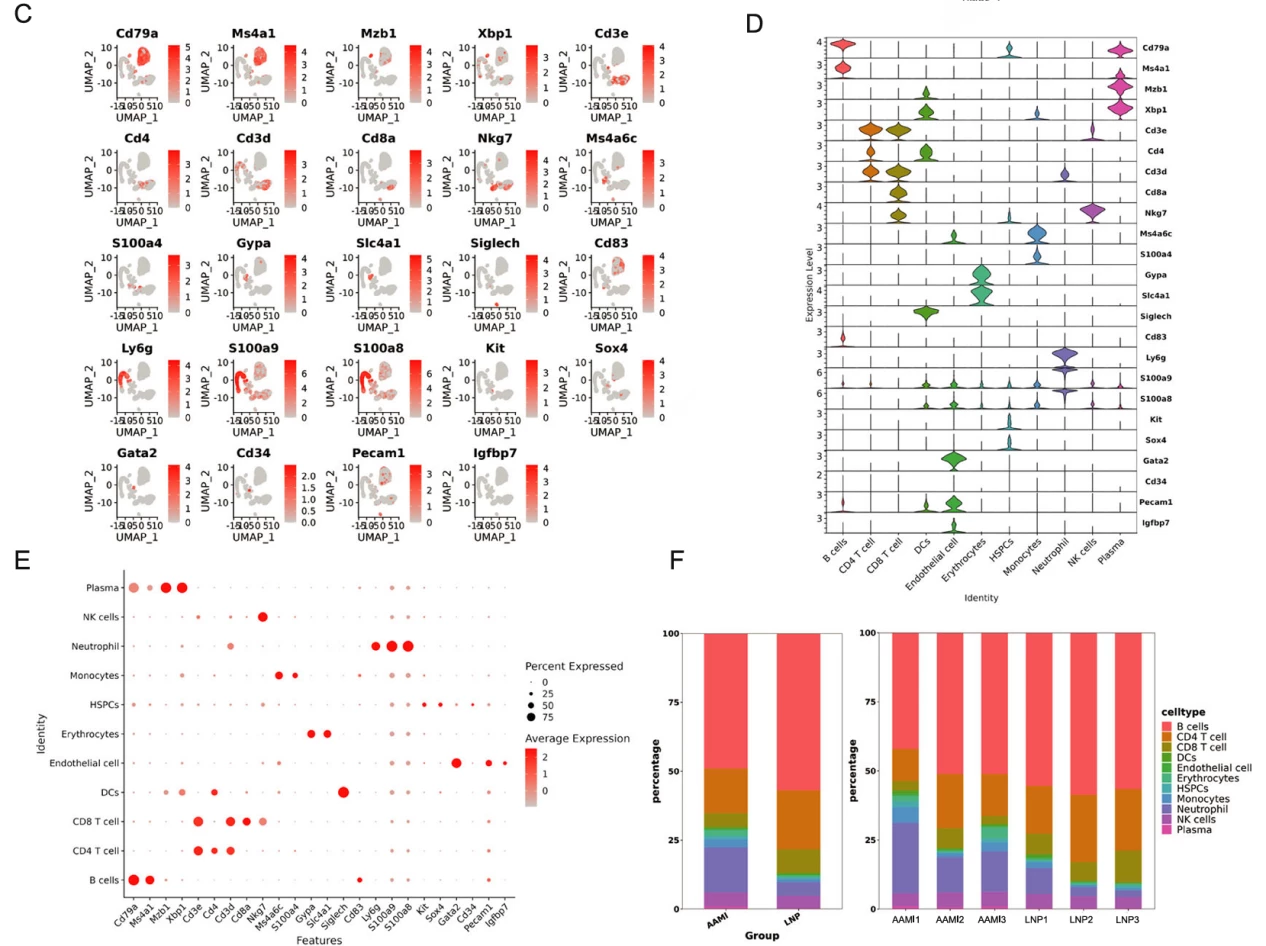
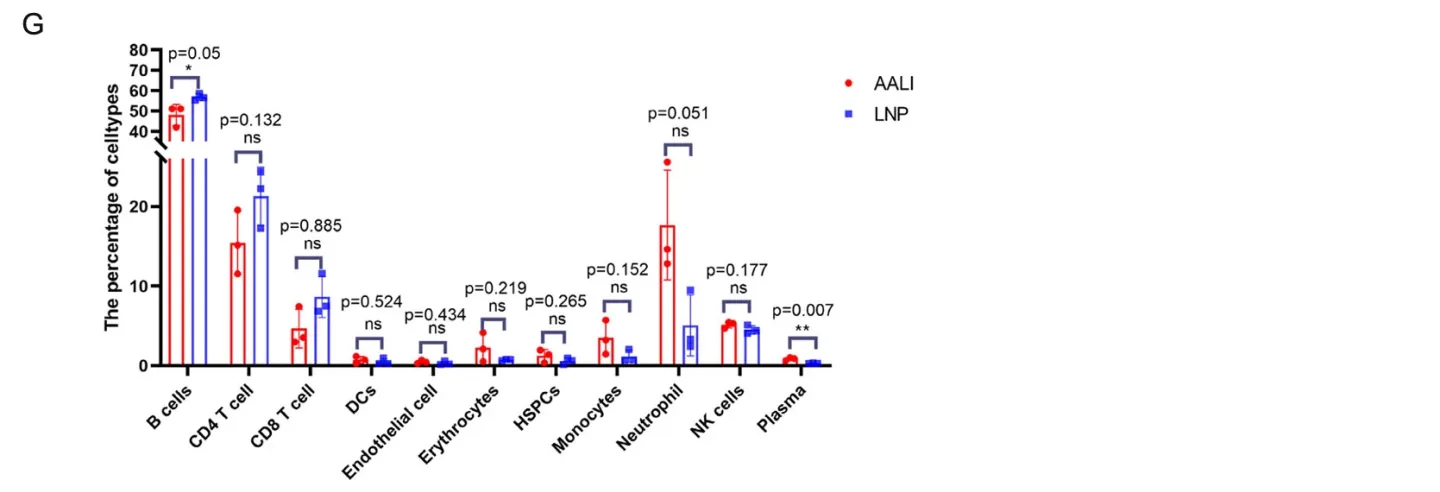
随后,研究者联合单细胞转录组学与免疫组学,探究了 BALB/c小鼠接种后在分子水平的响应变化,展示了11个亚细胞类型的基因表达差异。其中,接种疫苗后的小鼠脾脏中浆细胞的比例显著高于LNPs对照组。单核细胞和树突状细胞比例的上升虽未达到统计学显著性,但考虑到其免疫递呈的放大作用和作为疫苗靶细胞的作用机制,这些结果仍值得关注(Fig.5)。作者通过单细胞组学联合免疫组学,也得到了相应的VDJ序列,为后续的免疫突触、结构域互作研究提供了线索(Fig.6 -7)。
Fig.5
Fig.6
Fig.7
综上,该文章首次在单细胞水平上,系统评估了多价mRNA疫苗在MPXV感染中的免疫机制。展示了mRNA疫苗在快速响应新发传染病方面的潜力。为开发广谱正痘病毒疫苗提供了新策略。





























![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)