目录
1. 配制试剂
2. 微流控合成操作流程
3. 粒径与PDI的检测
4. 维生素C脂质体合成的放大(中试设备)
1. 配制试剂
2. 破乳前标曲制备及样品检测
3. 破乳后标曲制备及样品检测
4. 计算包封率
| 温馨提示:由于实验方案在不断优化更新,以下实验方案内容仅供参考,如有需要,请通过网站上的联系方式向工作人员获取实时更新的版本PDF文件。(FluidicLab编辑并发布,转载请通知我们)。 |
实验方案:微流控混合方式合成脂质体包裹维生素C
从小试测试到中试放大全流程
维生素C(抗坏血酸)作为一种重要的水溶性抗氧化剂,具有保护细胞免受氧化应激、促进免疫功能和改善皮肤健康等多重生物学作用。然而,维生素C其固有的化学不稳定性——易受光、热、氧和金属离子等因素影响而降解,以及在生物体内的快速代谢和有限的口服生物利用度,严重限制了其在功能性食品、营养保健品及医药领域的应用效能[1]。
为了克服这些挑战,基于脂质体的纳米递送系统应运而生。脂质体是由磷脂双分子层构成的封闭囊泡,其亲水内核能够高效包载维生素C等水溶性分子,同时其仿生膜结构不仅为内容物提供了物理隔绝保护,还有助于增强细胞摄取,从而有望显著提升维生素C的稳定性和生物利用度[2]。然而,传统方法(如薄膜水化法[3]、乙醇注入法[4])常存在粒径分布宽、批次重复性差、包封率不稳定等局限,且工艺步骤繁琐,易影响活性成分稳定性。相比之下,微流控技术通过精准控制两相流速、比例及混合模式,可实现脂质分子的均一、快速自组装,从而一步制备出粒径均一、结构稳定的脂质体,大幅提升了工艺可控性与重复性[5]。
本方案将系统描述微流控制备维生素C脂质体的实验方法,为实现维生素C的高效递送与功能强化提供重要的技术支撑。本实验方案有2大发现:1)传统脂质体合成方案的配方具有平移和复制到微流控平台的潜力和可能;2)我司的微流控方案从实验级别规模(如配方筛选)到中试放大生产具有良好的工艺一致性。
实验目的:
使用微流控的方式合成维生素C脂质体纳米颗粒
实验原理:
脂相的磷脂分子在水中自发排列形成双分子层结构,进而弯曲闭合构成囊泡。在这一过程中,溶解于水相中的维生素C分子被同时物理截留于正在形成的囊泡内部亲水腔中。最终形成的维生素C脂质体,凭借其磷脂双分子层结构实现了对活性成分的有效物理包封,从而获得保护性、增强细胞渗透性及潜在靶向性的递送功能。
实验材料:
| 试剂 | 脂相 | 蛋黄卵磷脂 | CAS:93685-90-6 |
| 大豆卵磷脂 | CAS:8030-76-0 | ||
| 胆固醇 | CAS: 57-88-5 | ||
| 吐温80(Tween 80) | CAS:9005-65-6 | ||
| 水相 | 柠檬酸 | CAS:5949-29-1 | |
| PBS | |||
| 维生素C(抗坏血酸) | CAS:50-81-7 | ||
| 溶剂 | 去离子水 | ||
| 耗材 | 合成需要 | BD/安得(AD)/KDL注射器套筒 | |
| 不同型号带鲁尔口的注射器若干 | |||
| Falcon 15mL、50mL离心管 | |||
| 微混合芯片 | FliudicLab C2 | ||
| 设备 | 试剂合成 | pH测试计 | |
| 涡旋仪 | |||
| 温控水浴锅 | |||
| 微流控合成 | FluidicLab智能纳米颗粒合成仪(型号:NP-S2) | ||
| 检测 | 动态光散射仪(型号:Malvern ZS90) | ||
实验步骤:
1.配置试剂
根据参考文献[4],合成脂质体配方通常含有,磷脂、胆固醇、吐温80三种成分,通常浓度比例为5:1:1,我们后续实验摸索调整了以上三种成分的比例(附录-附件一.1),其中与文献一致的是,当且仅当磷脂:胆固醇:吐温80浓度比=5:1:1时,合成脂质体的粒径与PDI效果更好。文献[4]中使用了乙醇注入法、但最佳配方与我们使用微流控法得到的最佳配方一致。证明了传统脂质体的方案具有平移或复制到微流控平台的可行性。
脂相:卵磷脂(14mg/mL) + 胆固醇(2.8mg/mL) + 吐温80(2.8mg/mL)
我们实验探索发现当总浓度为19.8mg/ml,即蛋黄卵磷脂浓度为14mg/ml时,脂质体合成后DLS检测的count rate适中,且DLS检测结果最佳(附录-附件一.2),并且大豆卵磷脂按照以上配方同样也可以合成较好的脂质体(附录-附件一.3)。因此,以无水乙醇作为脂相溶剂,按照以上对应浓度配置脂相溶液,并包裹锡纸进行防潮防氧化保存。
维生素C通常溶解在酸性水溶液或特定缓冲液中,因此pH对于维生素C的溶解以及包封溶解具有显著影响。我们探索了pH的数值对于维生素C合成的影响,发现当pH的值为6.8时,脂质体包裹维生素C合成的效果最好(附件-附件二)。
水相(pH6.8): PBS(1×) + 维生素C(0.46mg/mL) + 柠檬酸(调节pH)
配置1M柠檬酸,利用1M柠檬酸将溶解1×PBS的pH滴定到6.8,制作水相溶剂。按照以上对应浓度配置水相溶液,并保持现配现用,防止维生素C氧化。
2.微流控合成操作流程
可使用FluidicLab NP-S2快速合成

FluidicLab智能纳米颗粒合成仪(NP-S2)
在制备纳米颗粒(如LNP、Liposome)的过程中,关键步骤是有机相与缓冲液在微流控芯片中高速均匀的混合。通过先进的微流控技术,智能纳米颗粒合成仪(NP-S2)能够制备粒径高度均一且可控的纳米颗粒。经验证,S2同时具备了高重复性、低样本消耗、易于操作等优势,大幅提高了客户前期配方筛选的效率。
对于智能纳米颗粒合成仪器的使用方法,可观看我司网页上传的操作指导视频(https://www.bilibili.com/video/BV1Kg4y127tc?spm_id_from=333.1387.collection.video_card.click)
或参考我司LNP合成实验指南(https://www.fluidiclab.com//mrna-lnp-s1/)
(1)对于芯片进行预清洗,脂相利用无水乙醇,水相利用pH 6.8的1×PBS设置智能纳米颗粒合成仪器实验参数流速比为1:1,总流速12mL/min,产物0mL,前废液1mL,后废液0mL。
(2)合成脂质体时,分别将配置好的水相与脂相放在仪器对应位置。实验参数设置为流速比1:3,总流速16mL/min,有利于脂质体包裹维生素C的合成,可以获得粒径较小且均匀的脂质体维生素C纳米颗粒,流速比和粒径、PDI的关联见(附录-附件三)。
(3)后清洗时,与预清洗步骤相同。
3. 粒径和PDI的检测
由于脂质体维生素C纳米颗粒中含有25%的乙醇,高浓度乙醇会动态光散射仪DLS检测。因此,需要及时利用超纯水将初产物稀释10倍,即将初产物稀释到2.5%乙醇浓度进行检测。
正常结果如下图所示:
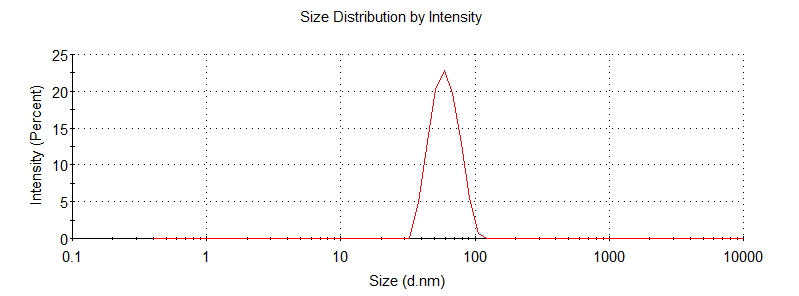
图1.脂质体维生素C动态散射仪光检测结果
并且,我们的检测结果显示,空包的脂质体与包裹维生素C的脂质体粒径与PDI相差不大,都合成效果较好(附录-附件四)。随后可以进行脂质体包裹维生素C的包封率检测。
4. 维生素C脂质体合成的放大(中试设备)
FluidicLab拥有成熟的小试及中试设备

FluidicLab中试纳米颗粒生产设备(NP-M1)
适用于脂质纳米颗粒(LNP)、脂质体(Liposome)、多聚物微球(如PLGA纳米颗粒)微囊、微乳Emulsion等不同药物载体的制备。此外,该系统可为科研及产业化提供成熟的设备、芯片的完整解决方案。
经测试,我们的仪器有着工艺平移放大的能力。相同的工艺,在小试设备NP-S2上验证后,可直接在NP-M1中试平台上进行合成。我们的后续实验结果显示,利用以上脂质体配方,在NP-M1中试平台中设置80ml/min的总流速,1:3的流速比合成的脂质体纳米颗粒,依旧具有较好的稳定性,空包实验与小试智能纳米颗粒合成仪器结果无明显差异,粒径与PDI的数值均较小(附录-附件五.1)。
加入维生素C后,我们同样进行了脂质体合成及DLS测试。中试仪器合成维生素C脂质体纳米颗粒的最高流速可达400ml/min,而其粒径与小试智能纳米颗粒合成仪器结果也接近,分别为小试:粒径=56.70 nm,PDI=0.0613;中试:粒径=53.46 nm,PDI=0.070,两者粒径与PDI的数值均较小且接近(附录-附件五.2)。
中试仪器合成结果检测峰图如下图所示:
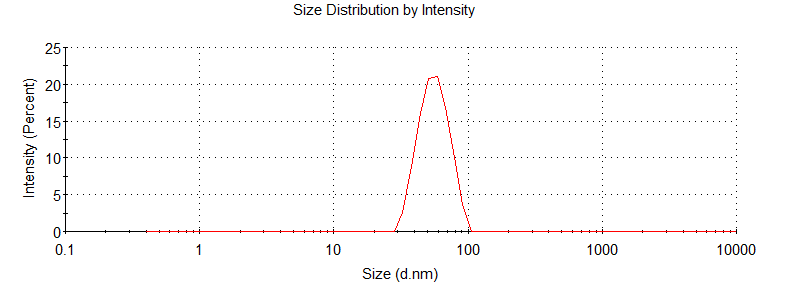
图2.中试仪器合成脂质体维生素C动态散射仪光检测结果
参考文献
[1]Doseděl, Martin et al. “Vitamin C-Sources, Physiological Role,Kinetics,Deficiency, Use, Toxicity, and Determination.” Nutrients vol. 13,2 615.
[2]Chaves, Matheus A et al. “Current Applications of Liposomes for the Delivery of Vitamins: A Systematic Review.” Nanomaterials (Basel, Switzerland) vol. 13,9 1557.
[3]Zhang, Hongwei. “Thin-Film Hydration Followed by Extrusion Method for Liposome Preparation.” Methods in molecular biology (Clifton, N.J.) vol. 1522 (2017): 17-22.
[4]WANG Ruijuan, MA Chunliu, YAN Haitao, et al. Lecithin/Cholesterol/Tween 80 Liposomes for Co-Encapsulation of Vitamin C and Xanthoxylin[J]. ACS Applied Nano Materials, 2024, 7(6): 5982-5995. [5]Hajimirzaei, Seyedeh Fatemeh, et al. “Extraction of phospholipid-rich fractions from egg yolk and soybean for the development of vitamin C-encapsulated liposomes via a microfluidic device.” Food chemistry vol. 494 (2025): 146260.
实验方案:固蓝B盐紫外分光光度法检测维生素C-脂质体包封率
针对脂质体包裹的维生素C使用率、包封率的检测成为了一大难题。目前,常规维生素C含量检测虽已建立多种方法,如高效液相色谱法(HPLC)、色谱-质谱联用法(LC-MS)、2,6-二氯靛酚滴定法、基于啡啰啉显色反应的分光光度法以及直接紫外分光光度法等,然而在应用于维生素C-脂质体这一复杂基质时,上述方法均存在明显局限,详细原因见(附录-附件六)。
为克服这些困难,参考相关文献[1],选定固蓝B盐紫外分光光度法作为脂质体包裹维生素C包封率测定的基础方法。该方法在选择性、灵敏度和操作简便性方面表现出较好潜力,尤其适用于含脂质体系的维生素C分析。为进一步提升其准确性与适应性,本研究对该方法进行了系统优化与条件改进,以建立一种更适用于维生素C-脂质体包封率评价的可靠检测方案。
实验目的:
检测维生素C脂质体纳米颗粒的包封效率
实验原理:
维生素C在弱酸至中性条件下可将固蓝B盐还原,自身氧化为脱氢抗坏血酸,同时固蓝B盐分解生成芳香胺中间体。该中间体与剩余试剂迅速偶联,形成在特定波长(如420 nm或540 nm)处有强吸收的有色偶氮化合物。其吸光度与维生素C浓度成线性关系,通过测定吸光度并对照标准曲线即可实现定量分析。
实验试剂:
| 试剂 | 0.2M Na2EDTA(EDTA二钠) #1 | CAS:139-33-3 |
| 0.5M CH3COOH(乙酸) | CAS:64-19-7 | |
| 固蓝B盐 | CAS:14263-94-6 | |
| 耗材 | 5mL EP管 | |
| 石英比色皿 #2 | ||
| 15mL离心管、枪头若干 | ||
| 仪器设备 | 紫外分光光度计 | |
#1:Na2EDTA具有比EDTA更好的中和能力
#2:固蓝B盐检测法检测波长为420nm,石英比色皿可用于190-900nm全波段检测,玻璃比色皿仅用于可见光波段。420nm接近紫外区,建议使用石英比色皿以提高检测精度。
实验步骤:
一、配置试剂
1、固蓝B盐溶液的配置
称取0.5g,溶于250 mL ddH2O中,配置终浓度为2g/L的固蓝B盐溶液。实验过程中注意避光,并现配现用。
# 注意固蓝B盐危险代码为R45: 可能致癌;R61: 可能对未出生的婴儿造成伤害;R20/21/22: 吸入、皮肤接触和吞食有害。使用和配置过程中请穿好实验服,佩戴手套、口罩、防护镜,确保使用安全。
2、进行预混液反应液【Mixture】的配置
每一个反应所需为1.5ml的【Mixture】,其中按如下比例配置试剂:
【Mixture】=+ 225 μL 【Na2EDTA (0.2 M)】+ 300 μL 【CH3COOH (0.5 M)】
+ 750 μL 【固蓝B盐溶液(2 g /L)】+ 225 μL 【1×PBS】
破乳前后各要进行一次标曲的制备,每次标曲需要6个反应因此:
【Mixture】准备数量=(6个标曲反应 × 2 + 检测样品数 ) + 2 个冗余反应
二、破乳前标曲制备及样品检测
本实验需分别制备破乳前后维生素C含量的两条标准曲线。每条曲线通常设置6个浓度梯度点,这能在较宽线性范围内保证结果的准确性。实际操作中,可根据所用紫外分光光度计的具体灵敏度与检测限进行适当调整,但需确保最高吸光度低于1.5。整个过程应使用经校准的移液器,确保加样精度。
1、未破乳体系标准曲线(用于测定“游离Vc”)
制作测定样品中未被脂质体包封的游离维生素C含量的相关标曲。按下表1顺序和用量依次加入各组分,涡旋混匀。
表1
| 标点编号 | 1(空白) | 2 | 3 | 4 | 5 | 6 |
| 空包脂质体 (μL) | 500 | |||||
| Vc标准品 (1mg/mL, μL) | 0 | 10 | 20 | 50 | 100 | 200 |
| 1× PBS (μL) | 1000 | 990 | 980 | 950 | 900 | 800 |
| 总体积 (μL) | 1500 | |||||
| Vc终浓度 (μg/mL) | 0 | 20 | 40 | 100 | 200 | 400 |
关键说明:脂质体本身于420nm波长处有一定的吸收,故在做破乳前后标曲的时候,加入等量空包脂质体是为了校正其在检测波长下的背景吸收(详见附录-附件六-图4)。
2、配置破乳前待测脂质体包封样品 = 500μL【待测脂质体样品】+ 1000 μL【1×PBS】
3、将以上配置的1.5 mL标曲以及样品,加入1.5 mL 预混液反应液【Mixture】,组成3 mL的反应测量液体,在配置完成后静置30min
4、在等待静置同时,打开紫外分光光度计进行预热,一般至少预热10min。然后,加入3 mL ddH2O石英比色皿进行调零
5、进行破乳前标曲的测量(图1 右侧)

图1.破乳前的标曲制备及标曲示意图
6、对破乳前样品进行测量,并记录吸光度,后续根据破乳前标曲计算出维生素C浓度
三、破乳后标曲制备及样品检测
1、破乳体系标准曲线(用于测定“总Vc”)
制作测定包含包封与游离态在内的总维生素C含量的相关标曲。按下表2顺序和用量依次加入各组分,涡旋混匀。
表2
| 标点编号 | 1(空白) | 2 | 3 | 4 | 5 | 6 |
| 空包脂质体 (μL) | 500 | |||||
| Vc标准品 (1mg/mL, μL) | 0 | 10 | 20 | 50 | 100 | 200 |
| 1× PBS (μL) | 1000 | 990 | 980 | 950 | 900 | 800 |
| 8% TritonX-100 (μL) | 375 | |||||
| 总体积 (μL) | 1500 | |||||
| Vc终浓度 (μg/mL) | 0 | 20 | 40 | 100 | 200 | 400 |
2、破乳后待测脂质体包封样品 = 500μL【待测脂质体样品】+ 375 μL【8% Triton X-100】 + 625 μL【1×PBS】
3、将以上配置的标曲以及样品加入Triton X-100后,需涡旋混匀并于室温静置3分钟,确保脂质体被完全破坏。
4、将以上配置的1.5 mL标曲以及样品,加入1.5 mL 预混液反应液【Mixture】,组成3 mL的反应测量液体,在配置完成后静置30min
5、在等待静置同时,打开紫外分光光度计进行预热,一般至少预热10min。然后,加入3 mL ddH2O石英比色皿进行调零
6、进行破乳前标曲的测量(图2 右侧)

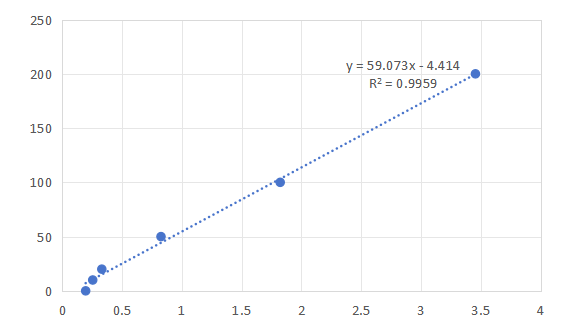
图2.破乳前的标曲制备及标曲示意图
7、对破乳前样品进行测量,并记录吸光度,后续根据破乳前标曲计算出维生素C浓度
如图1-2所示破乳前后,相同浓度的维生素C也存在差异。故两个标曲是必要的
四、计算包封率
1、进行包封率的计算,公式为:
载药量 = 破乳后读值 - 破乳前读值
包封率(%) = [载药量/破乳后读值] × 100%
2、同时可进行维生素C利用率的计算,公式为:
利用率 (%) = [载药量/维生素C投入量] × 100 %
参考文献
[1]Wang, R.; Ma, C.; Yan, H.; et al. Lecithin/Cholesterol/Tween 80 Liposomes for Co-Encapsulation of Vitamin C and Xanthoxylin. ACS Appl. Nano Mater. 2024, 7 (6), 5982–5995.
附录
附件清单:
附件一 脂相试剂相关配比对脂质体粒径/PDI的影响
1、脂相三种成分比例对脂质体粒径/PDI的影响
2、脂相总浓度对脂质体粒径/PDI的影响
3、卵磷脂种类对脂质体粒径/PDI的影响
附件二 水相试剂的pH对脂质体粒径/PDI的影响
附件三 微流控参数(流速比)对脂质体粒径/PDI的影响
附件四 维生素C包裹对脂质体粒径/PDI的影响
附件五 中试仪器与小试仪器合成脂质体粒径/PDI对比
1、中试仪器与小试仪器合成脂质体粒径/PDI对比
2、中试仪器与小试仪器合成维生物C脂质体粒径/PDI对比
附件六 维生素C-脂质体包封率的检测方法比较
附件一:脂相试剂相关配比对脂质体粒径/PDI的影响
1、脂相三种成分比例对脂质体粒径/PDI的影响
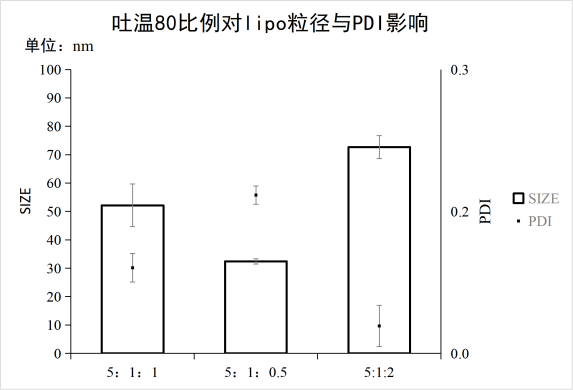

实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见当试剂浓度,卵磷脂:胆固醇:吐温80=5:1:1时,脂质体合成的粒径与PDI较佳。
2、脂相总浓度对脂质体粒径/PDI的影响
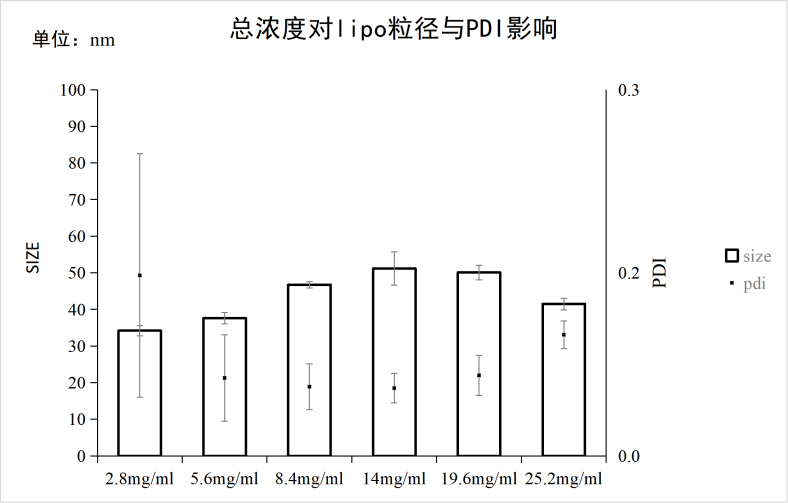
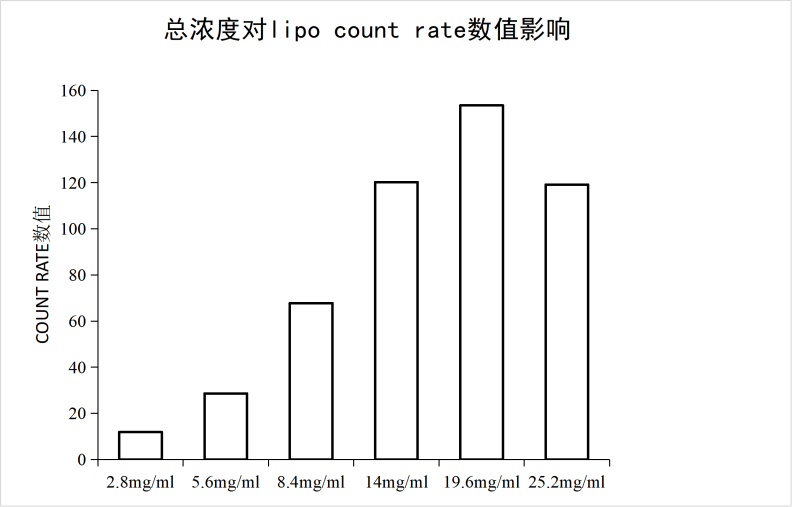
实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见当脂质总浓度为19.6mg/ml时,即卵磷脂浓度为14mg/ml、胆固醇浓度为2.8mg/ml、吐温80浓度为2.8mg/ml时,脂质体合成的粒径与PDI较佳,并且COUNT RATE数值也最高,表明合成浓度较高与检测较准确。
3、卵磷脂种类对脂质体粒径/PDI的影响

实验条件:仪器:Fluidiclab-S2 ;芯片:Fluidiclab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见蛋黄卵磷脂与大豆卵磷脂根据本实验的配方,均可以合成脂质体纳米颗粒并且粒径与PDI较小,纳米颗粒较均一。
附件二:水相试剂的pH对脂质体粒径/PDI的影响

实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见当水相的pH值为6.8时合成的脂质体纳米颗粒粒径与PDI都较佳。
附件三:微流控参数(流速比)对脂质体粒径/PDI的影响
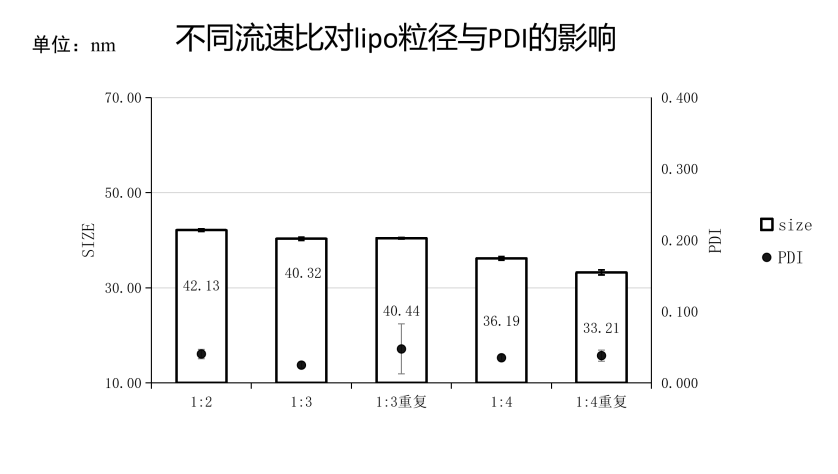
实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测可见当流速比为1:3时,合成的脂质体纳米颗粒粒径与PDI都较佳。
附件四:维生素C包裹对脂质体粒径/PDI的影响
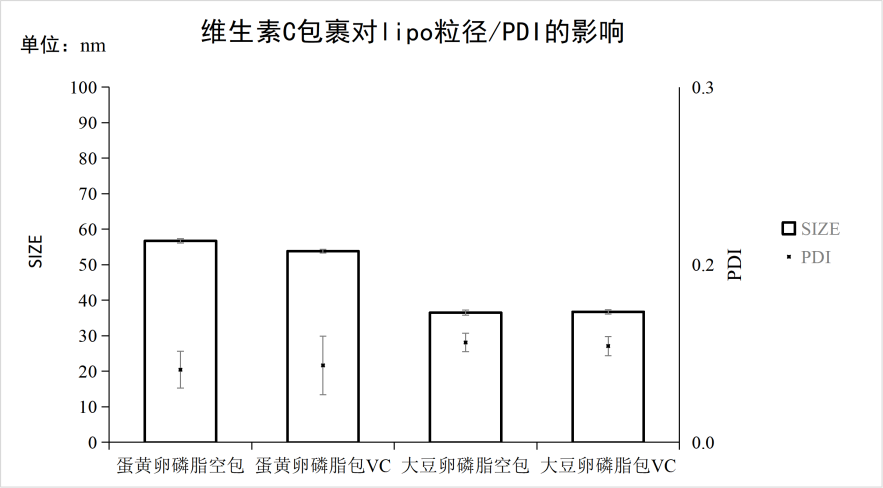
实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见蛋黄卵磷脂与大豆卵磷脂合成的脂质体在包封维生素C前后,粒径与PDI没有显著性差异,并且合成的纳米颗粒较均一。
附件五 中试仪器与小试仪器合成脂质体粒径/PDI对比
1、中试仪器与小试仪器合成脂质体粒径/PDI对比

小试实验参数
实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
中试实验参数
实验条件:仪器:NP-M1;芯片:FluidicLab-MT1-FL-V075
微流控参数:总流速(TFR):80mL/min;
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测
可见小试智能纳米颗粒合成仪与中试高通量微流控仪器,合成的脂质体纳米颗粒粒径与PDI均较佳,两者之间无显著性差异。
2、中试仪器与小试仪器合成维生物C脂质体粒径/PDI对比

小试实验参数
实验条件:仪器:FluidicLab-S2;芯片:FluidicLab-C2
微流控参数:总流速(TFR):16mL/min;
流速比(FRR):脂相:水相 = 1:3
中试实验参数
实验条件:仪器:NP-M1;芯片:FluidicLab-MT1-FL-V075
微流控参数:总流速(TFR):100mL/min;400mL/min
流速比(FRR):脂相:水相 = 1:3
检测参数:将产物利用纯水稀释10倍,即将乙醇浓度稀释为2.5%进行DLS检测可见小试智能纳米颗粒合成仪与中试高通量微流控仪器,合成的维生素C脂质体纳米颗粒粒径与PDI均较佳,两者之间无显著性差异,表明此脂质体维生素C配方具有可放大高通量效应。
附件六 维生素C-脂质体包封率的检测方法比较
1、高效液相色谱或色谱-质谱联用检测
无论是高效液相色谱(HPLC)或者色谱-质谱(LC-MS),首先需要有昂贵的检测设备以及耗材。需要超高纯度的试剂来降低污染且操作流程复杂,导致了使用的高门槛。配方优化中,需要每一种测试条件够以低成本,高效地进行包封率检测。而方法HPLC或者LC-MS联用检测与该需求是相悖的。所以我们最先排除了它。当然,如果后续实验配方已经确定,并且需要进一步的精确测量,HPLC及LC-MS仍然可以是首选方案。
2、2,6-二氯靛酚滴定法
此方法是国标的维生素C检测方式之一。其滴定终点会呈现淡淡的粉色(图1)。

我们也按照国标检测步骤进行了测试。该方法的优点是,滴定对于乙醇,pH,甚至Triton X-100等破乳剂干扰影响不显著;同时,操作及其简便,检验快速。但对于标准品的滴定发现,即使100μL滴定量的偏差(约相当于50μg的维生素C滴定量),按要求静置15秒后粉色颜色的深浅差异也并不明显,依赖主观判断。特别是2,6-二氯靛酚滴定终点的浅粉色还会随时间逐渐消退。故该方法舍弃不用。
3、菲啰啉显色反应进行检测
使用菲啰啉显色反应进行检测。该方法虽对于标准品有很好的线性关系,但相关试剂的配置用到了大量乙醇,会直接导致脂质体被溶解和破坏,释放维生素C,令包封率检测结果偏低。故该方法也不适合脂质体包裹维生素C的包封率检测。
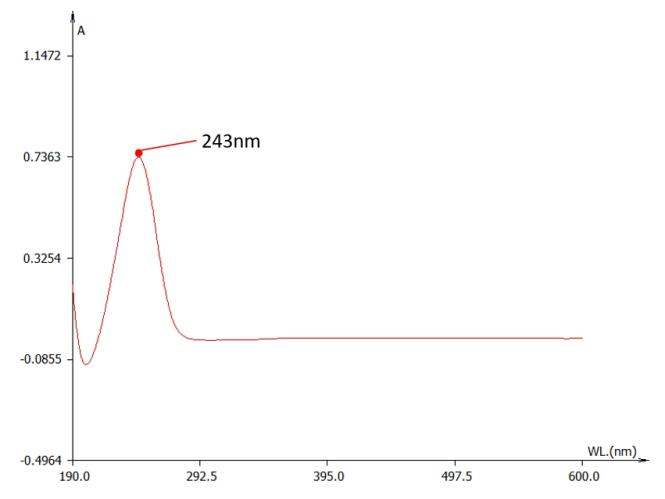
4、紫外分光光度计检测
直接用紫外分光光度计检测。我们对标准品进行了光谱扫描。我们发现,在稀硫酸中的维生素C的吸收峰位于243nm附近(图2.),符合文献报道的245nm吸收峰:
稀硫酸中维生素C的紫外吸收曲线
然而,溶解于PBS中的Vc吸收峰位于298nm附近;这意味着随着pH的变化,维生素C的紫外吸收峰发生红移(图3.)
1×PBS中维生素C的紫外吸收曲线
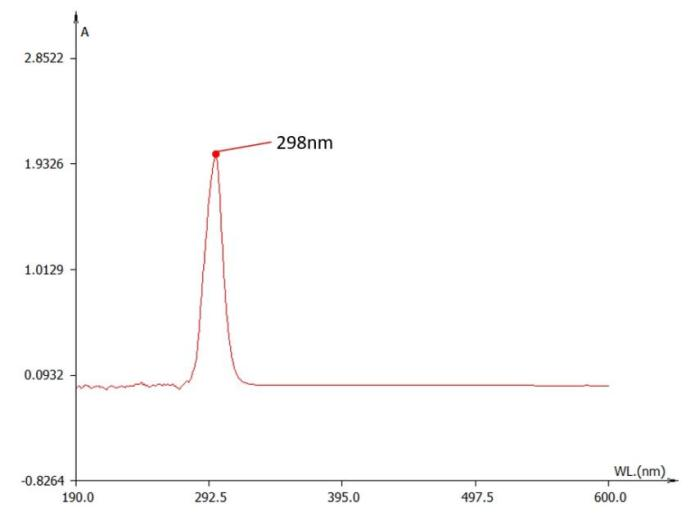
我们也对空白的空载脂质体进行了紫外光谱扫描。结果显示其在295nm峰值附近有较强吸光度。
1×PBS脂质体的紫外吸收曲线
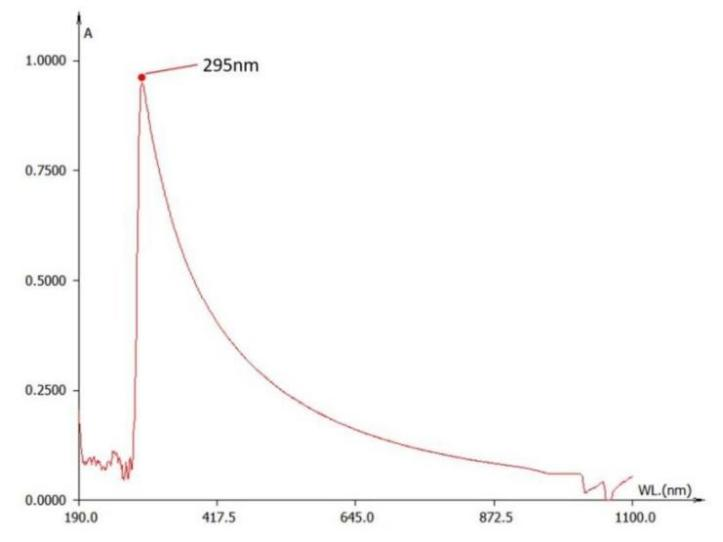
而脂质体在合成后,一般会置换和保存于PBS等中性溶液中。该峰值与红移后的维生素C重叠(图3、图4)。故该方法最终也被我们排除。
值得注意的是,图4的结果也说明,脂质体在420nm附近仍有一定的吸光度。在使用固蓝B溶液检测的时候,标准样需要加入空白脂质体以确保检测条件一致。



























![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)