目录
实验方案:微流控混合方式制备壳聚糖纳米颗粒
1.配制试剂
2.微流控合成操作流程
3.初产物处理
4.粒径与PDI的检测
5.产物处理与储存
实验方案:微流控混合方式制备壳聚糖纳米颗粒
壳聚糖纳米颗粒(Chitosan Nanoparticles, CS NPs)作为一种具有广泛应用的纳米材料,因其良好的生物相容性、生物降解性、非毒性、可调节性以及能够载药等优点,在生物研究、药物递送、医疗、食品、环境保护等多个领域得到广泛研究与应用。如:进行体外细胞siRNA的递送[1],使靶基因沉默。通过将药物载入壳聚糖纳米颗粒中,可以实现药物的缓慢释放[2]。壳聚糖纳米颗粒包裹保护活性成分后(如维生素[3]、矿物质[4]、益生菌等[5]),可以提高递送效率。此外,壳聚糖纳米颗粒还被用于土壤修复,吸附和去除土壤中的污染物。在其中载入农药,还可以进行农业虫害防治[6,7]。另外较小尺寸的壳聚糖纳米颗粒通过载入美容产品中的活性成分(如透明质酸、肽类、植物提取物等),从而帮助这些活性成分传递到皮肤的深层[8,9]。具有较为广泛的应用前景。
目前已有多种制备壳聚糖纳米颗粒的技术,例如离子凝胶法、乳液滴法、喷雾干燥法、凝聚法以及自组装化学修饰法等。在不同的CS NPs合成方法中,离子凝胶法是最常用于制备CS NPs的方法,因为该方法作用条件温和,并且使用无毒溶剂和安全的交联剂。该方法涉及带正电荷的CS氨基与阴离子小分子(即硫酸钠、三聚磷酸钠(Sodium Tripolyphosphate, TPP)等)的离子相互作用,从而形成基于CS的NPs。其中TPP阴离子交联剂被认为是最可利用、无毒和安全的CS交联剂。
离子凝胶化法合成CS/TPP NPs尽管在工艺优化方面做出了大量努力,但该方法生产效率低、批次重现性较差、制作过程耗时。而微流控作为新兴技术,在合成CS/TPP NPs方面表现出了显著的优势。与传统的离子凝胶化法相比,微流控技术能够在更精确的流速控制下,按照微流控芯片既定的流道进行流动混合,提供了更佳的批次均匀性。本方案将通过微流控技术结合离子凝胶法原理合成壳聚糖纳米颗粒(CS/TPP NPs)以及壳聚糖/siRNA纳米颗粒的实验方法。
实验目的:
使用微流控的方式合成CS/TPP纳米颗粒以及CS/TPP-siRNA纳米颗粒
实验原理:
在稀酸溶液中,壳聚糖(CS)分子链上的氨基被质子化为阳离子型的NH3+;三聚磷酸钠(TPP)是一种阴离子交联剂,其溶液中含有大量带负电荷的PO-基团。在水溶液中,壳聚糖分子链上的NH3+与PO-发生结合而形成稳定的壳聚糖纳米颗粒。具体反应过程如下式所示:
Chitosan-NH3+-AC + TPP-PO-Na+→Chitosan-NH3+-PO-TPP
由于siRNA在其磷酸骨架上携带负电荷,能与带正电的壳聚糖通过静电作用形成稳定的纳米复合物,其中选择TPP作为交联剂来连接壳聚糖聚合物,可以形成及CS/TPP-siRNA纳米颗粒。
实验材料:
| 试剂 | 水相1(仪器脂相) | 壳聚糖(C6H11NO4)n | CAS:9012-76-4 |
| 醋酸(C2H4O2) | CAS:64-19-7 | ||
| 水相2/3(仪器水相) | 三聚磷酸钠(Na5P3O10) | CAS:7758-29-4 | |
| 吐温80(Tween 80) | CAS:9005-65-6 | ||
| siRNA | |||
| 蔗糖 CAS:57-50-1 | |||
| 溶剂 | 去离子水 | ||
| 耗材 | 合成需要 | BD/安得(AD)/KDL注射器套筒 | |
| 不同型号带鲁尔口的注射器若干 | |||
| Falcon 15mL、50mL离心管 | |||
| 过滤 | 0.22μm PTFE滤膜 | ||
| 微混合芯片 | FluidicLab C2 | ||
| 设备 | 试剂合成 | pH测试计 | |
| 涡旋仪 | |||
| 温控水浴锅 | |||
| 微流控合成 | FluidicLab智能纳米颗粒合成仪(型号:NP-S2) | ||
| 检测 | 动态光散射仪(型号:Malvern ZS90) | ||
| 冷冻干燥 | 冷冻干燥机 | ||
实验步骤:
1.配置试剂
根据参考文献[10],壳聚糖需要乙酸促溶,而后续需要加吐温80作为表活和稳定剂。所以我们除了壳聚糖和TPP外,需要额外加入乙酸和吐温80两样辅料。随后进行的预实验发现,吐温80与壳聚糖混合后,纳米颗粒合成效果不佳(结果未展示)。故我们选择使用乙酸促溶CS;TPP与吐温80进行混合作为微流控混合的两相液体。
水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
吸取100μL的纯醋酸溶液到50mL离心管中,加入约10mL的去离子水;称取0.2g的壳聚糖,放入含有稀醋酸溶液的50mL离心管中,利用涡旋仪,进行涡旋混合;待大部分壳聚糖粉末溶解后,加入去离子水定容至20mL,进行涡旋混合,60℃水浴30min左右,促进溶解;利用0.22μm PTFE滤膜过滤,去除未溶解颗粒及杂质后利用pH计测量溶液pH值。pH应当在4.5左右。
由于pH高低会影响物质解离,所以不同的pH下,等量的CS/TPP会提供不同数量的NH3+和PO-离子,从而导致CS/TPP NPs的合成结果差异。我们的测试发现,在pH4.5的情况下,合成的CS/TPP NPs质量是最好的(附录-附件一.1)。
CS/TPP NPs-水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
称取0.2gTPP粉末,加入50mL离心管中,利用去离子水定容至20mL,配置10mg/mL的TPP母液;吸取4mL的TPP母液,加入20mL去离子水进行溶解;加入200μL的吐温80,进行充分溶解,利用去离子水定容至40mL;利用0.22μm PTFE滤膜过滤,去除未溶解颗粒。我们发现吐温80的存在会影响合成粒径大小以及粒径的分布。随着吐温80体积比的增加,粒径逐渐减小,但PDI逐渐增大(附录-附件一.2)。
此外,有效成分的质量比(附录-附件一.3)、双水相中有效成分的浓度(附录-附件一.4)会显著影响CS/TPP NPs合成的粒径和PDI。当且仅当壳聚糖(CS)浓度达到10mg/mL(含有0.5%醋酸),且三聚磷酸钠(TPP)溶液:浓度达到1mg/mL(含0.5%(v/v)吐温80)时,合成的CS/TPP NPs纳米颗粒在保证粒径分布较为均一的前提下,粒径、PDI相对较小。
注意:试剂推荐现用现配,并恢复至室温使用。目前,我们探索发现TPP的期限2 day(附录-附件二.1),壳聚糖可以保存4 day(附录-附件二.2),但试剂配置较久后CS与TPP的电离离子数目可能失衡,影响CS/TPP NPs的合成效果。此外,温度也对合成有一定的影响,请务必将试剂平衡至室温后进行合成(附录-附件二.3)。
CS/TPP-siRNA NPs水相3-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80+siRNA(30ng/μL)
将siRNA利用1mg/ml含0.5%(v/v)吐温80的TPP水溶液(水相2)进行稀释,将siRNA浓度稀释为30ng/μL。稀释好的siRNA、TPP、吐温80混合溶液,常温下孵育30min。
2.微流控合成操作流程

FluidicLab智能纳米颗粒合成仪(NP-S2)
在制备纳米颗粒(如LNP、Liposome)的过程中,关键步骤是有机相与缓冲液在微流控芯片中高速均匀的混合。通过先进的微流控技术,智能纳米颗粒合成仪(NP-S2)能够制备粒径高度均一且可控的纳米颗粒。经验证,S2同时具备了高重复性、低样本消耗、易于操作等优势,大幅提高了客户前期配方筛选的效率。
·可使用FluidicLab NP-S2 快速合成
对于智能纳米颗粒合成仪器的使用方法,可观看我司网页上传的操作指导视频(https://www.bilibili.com/video/BV1Kg4y127tc?spm_id_from=333.1387.collection.video_card.click)
或参考我司LNP合成实验指南(https://www.fluidiclab.com/mrna-lnp-s1/)
(1)由于试剂都是水相溶液,因此预清洗建议使用0.22μm PTFE滤膜过滤超纯水,进行智能纳米颗粒合成仪器NP-S2,脂相与水相的预清洗。智能纳米颗粒合成仪器实验参数推荐设置流速比为1:1,总流速12mL/min,产物0mL,前废液1mL,后废液0mL。
(2)将水相1壳聚糖(CS)溶液放置在智能纳米颗粒合成仪器NP-S2的脂相位置,水相2或带有siRNA水相3三聚磷酸钠(TPP)溶液放置在仪器的水相位置。通过测试,我们发现合成空包CS/TPP NPs时,智能纳米颗粒合成仪器实验参数设置为流速比1:3,总流速16mL/min,最有利于NPs的合成,可以获得粒径较小且均匀的CS/TPP NPs及CS/TPP-siRNA NPs。
(3)后清洗时,由于使用壳聚糖溶液具有一定粘性,因此推荐增加清洗体积。智能纳米颗粒合成仪器实验参数推荐设置为流速比1:1,总流速12mL/min,产物0mL,前废液2mL,后废液0mL,重复清洗3次。
(4)在优化流速比的过程中发现,在双水相浓度不变的情况下,流速比的改变会显著影响NPs粒径的大小和PDI。流速比和粒径、PDI的关联见附录-附件三.1。
此外,我们在探索中发现,产物中TPP、CS终浓度一致不代表其合成NPs的产物质量一致。如:CS(10 mg/mL):TPP(1 mg/mL)流速比=1:3合成的产物,对比CS(5 mg/mL):TPP(1.5 mg/mL)流速比=1:1合成的NPs产物。两者终浓度均为2.5mg/mL的CS及0.75mg/mL的TPP,但是CS/TPP NPs粒径大小具有显著性差异。该实验结果表明,NPs的合成本质是动态流动控制的反应过程,并非是一个静态合成的过程,并且该形成过程受流体动力学参数的显著影响。因此利用NP-S2智能纳米颗粒合成仪器按照优化后的结果进行CS/TPP NPs的合成,会更具有稳定性与可重复性。(具体实验数据参考附录-附件三.2)
3、初产物处理
由于初合成的NPs凝胶网络仍然存在去离子水溶剂中,电子束的热量促进了分子间的联系,会导致合成的单个颗粒以极快的速度(秒/分钟级)融合成一个整体[11]。从而导致合成的NPs产物中含有少部分粒径大于1μm的产物,因此我们建议使用0.22μm PTFE滤膜对初产物进行过滤,即可以获得粒径较小,且均一性较好的纳米颗粒。后续再进行稀释检测粒径与PDI。(具体实验数据参考附录-附件四)。
4. 粒径和PDI的检测
合成的NPs 可以使用动态光散射仪进行检测,其中主要检测指标为粒径与PDI(均一度)。由于CS/TPP NPs合成所需溶剂都为去离子水,因此我们推荐使用去离子水按照产物:水=1:1比例进行稀释(稀释浓度的具体影响参考附录-附件五),从而减少合成产物检测消耗,并提高检测准确度。正常通过本方案实验参数合成的CS/TPP NPs结果如下图1所示。
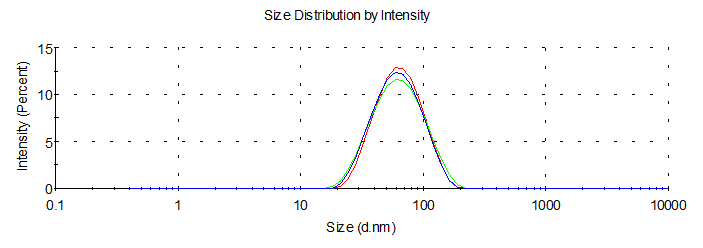
图1 CS/TPP NPs 动态光散射仪检测结果(三次检测)
空包CS/TPP NPs与负载siRNA的CS/TPP-siRNA NPs,粒径与PDI相差并不大,并且均一性都较好。siRNA影响壳聚糖纳米颗粒,粒径与PDI的结果(具体实验数据参考附录-附件六)。
5、产物处理与储存
我们的实验结果表明,短期(48h内)时间,滤后的初产物直接储存在4度可以保持CS/TPP NPs的稳定性。
CS/TPP NPs若以水悬浮液形式长期储存,容易发生体积膨胀甚至破裂。颗粒中聚合物可能发生溶解或降解,从而导致药物泄漏或解吸附[12,13,14]。
因此,对于长期储存,推荐在滤后初产物中添加5%w/v的蔗糖当作冷冻保护剂,使用冷冻干燥机将样品在-60 °C下冷冻3 h,并在减压条件下(<50Pa)冷冻干燥15~24h,从而保持CS/TPP NPs的重悬浮性和分散性。
冻干后,重悬CS/TPP NPs需要通过超声处理10分钟并在双蒸馏水中手动摇动重构纳米颗粒,进行后续实验使用。若重悬后不立即使用,可以暂时(24h内)存放在4度。(具体实验数据参考附录-附件七)
参考文献
[1] Feng J. Y., Huang W. W., Zhan Q. Y., et al. Flash nanoprecipitation fabrication of chitosan/sodium tripolyphosphate nanoparticles for siRNA delivery. Polym. Bull. (in Chinese), 2025, 38(3), 460–471.
[2] Khayati M, Manjili H K, Soleimani M, et al. Microfluidic synthesis of zoledronic acid loaded chitosan nanoparticles used for osteogenic differentiation of mesenchymal cells. Int J Biol Macromol. 2023 Apr 15;234:123056.
[3] Teng Z, Luo Y, Wang Q. Carboxymethyl chitosan-soy protein complex nanoparticles for the encapsulation and controlled release of vitamin D₃. Food Chem. 2013 Nov 1;141(1):524-32.
[4] Mrwad A A, El-Shafey S E, Said N M. Chitosan-encapsulated selenium nanoparticles alleviate CCl induced hepatotoxicity through synergistically modulating NF-κB and Nrf2 signaling pathways and regulating Bcl-2 and Caspase-3 expression: A comprehensive study with multiple regression analysis. J Trace Elem Med Biol. 2024 Dec;86:127563.
[5] Liu R, Ci X, Liu L,et al. Chitosan entrapping of sodium alginate / Lycium barbarum polysaccharide gels for the encapsulation, protection and delivery of Lactiplantibacillus plantarum with enhanced viability. Int J Biol Macromol. 2024 Mar;260(Pt 2):129615.
[6] Kandasamy G, Manisekaran R, Arthikala M K. Chitosan nanoplatforms in agriculture for multi-potential applications - Adsorption/removal, sustained release, sensing of pollutants & delivering their alternatives - A comprehensive review. Environ Res. 2024 Jan 1;240(Pt 1):117447.
[7] Kolge H, Kadam K, Galande S, et al. New Frontiers in Pest Control: Chitosan Nanoparticles-Shielded dsRNA as an Effective Topical RNAi Spray for Gram Podborer Biocontrol. ACS Appl Bio Mater. 2021 Jun 21;4(6):5145-5157.
[8] Hatem S, Elkheshen S A, Kamel AO, et al. Functionalized chitosan nanoparticles for cutaneous delivery of a skin whitening agent: an approach to clinically augment the therapeutic efficacy for melasma treatment. Drug Deliv. 2022 Dec;29(1):1212-1231.
[9] Owczarek M, Herczyńska L, Sitarek P, et al. Chitosan Nanoparticles-Preparation, Characterization and Their Combination with Ginkgo biloba Extract in Preliminary In Vitro Studies. Molecules. 2023 Jun 23;28(13):4950.
[10] Megha Agarwal, Mukesh K. Agarwal; Nalini Shrivastav, et al.Preparation of Chitosan Nanoparticles and their In-vitro Characterization.Int J Life Sci Scienti Res. 2018 Feb 22;4(2):1713-1720.
[11] Rampino A, Borgogna M, Blasi P, et al. Chitosan nanoparticles: preparation, size evolution and stability. Int J Pharm. 2013 Oct 15;455(1-2):219-28.
[12] Katas H, Raja M A G, Lam K L. Development of chitosan nanoparticles as a stable drug delivery system for protein/siRNA. Int J Biomater. 2013;2013:146320.
[13] Tsai M L, Chen R H, Bai S W, et al. The storage stability of chitosan/tripolyphosphate nanoparticles in a phosphate buffer. Carbohydr Polym. 2011;84(2):756–61.
[14] Rampino A, Borgogna M, Blasi P, et al. Chitosan nanoparticles: Preparation, size evolution and stability. Int J Pharm. 2013;455(1–2):219–28.
实验方案:测定壳聚糖siRNA纳米颗粒包封率
实验目的:
对使用微流控混合方式制备壳聚糖/siRNA纳米颗粒的包封率进行检测。
实验试剂:
| 试剂 | Qubit™ microRNA 定量试剂盒(Q32880,Invitrogen) |
| 琼脂糖凝胶电泳相关试剂 | |
| 耗材 | Axygen 0.5ml 离心管(MCT-500-T,Axygen) |
| 枪头若干 | |
| 琼脂糖凝胶电泳相关耗材 | |
| 仪器设备 | Qubit 4.0 Invitrogen |
| 琼脂糖凝胶电泳相关仪器 |
实验步骤:
注:检测siRNA浓度步骤可以参考Qubit™ microRNA 定量试剂盒说明书
将siRNA壳聚糖纳米颗粒合成试剂水相3:siRNA、TPP、吐温80混合液,进行siRNA浓度检测,计为C1。
合成的siRNA壳聚糖纳米颗粒悬浮液。使用超瞬时离心方法,将siRNA负载的壳聚糖纳米颗粒与未包封的自由siRNA分离,将上清液进行siRNA浓度检测,记为C2。
siRNA负载的壳聚糖纳米颗粒,计算包封率=(C1-C2/C1)*100%
利用琼脂糖凝胶电泳进行进一步的验证,制备2%琼脂糖凝胶,在1×TAE缓冲液进行电泳。分别加入40μL的siRNA壳聚糖纳米颗粒合成试剂水相3:siRNA+TPP+吐温80混合液、空载的壳聚糖纳米颗粒、siRNA负载壳聚糖纳米颗粒的上清液,三种样品。
利用100V电压进行电泳,电泳时间设置为60分钟。
将电泳完毕的琼脂糖凝胶,使用紫外照射仪照射,并观察siRNA条带的迁移。
游离siRNA包封率及琼脂糖凝胶电泳检测结果如下图1所示。其中,图B琼脂糖凝胶电泳结果。siRNA被包裹入壳聚糖后,纳米颗粒无法通过琼脂糖间隙从而被截留于加样孔内,只显示出游离siRNA的荧光,有力地证明了siRNA被包裹在壳聚糖纳米颗粒中。
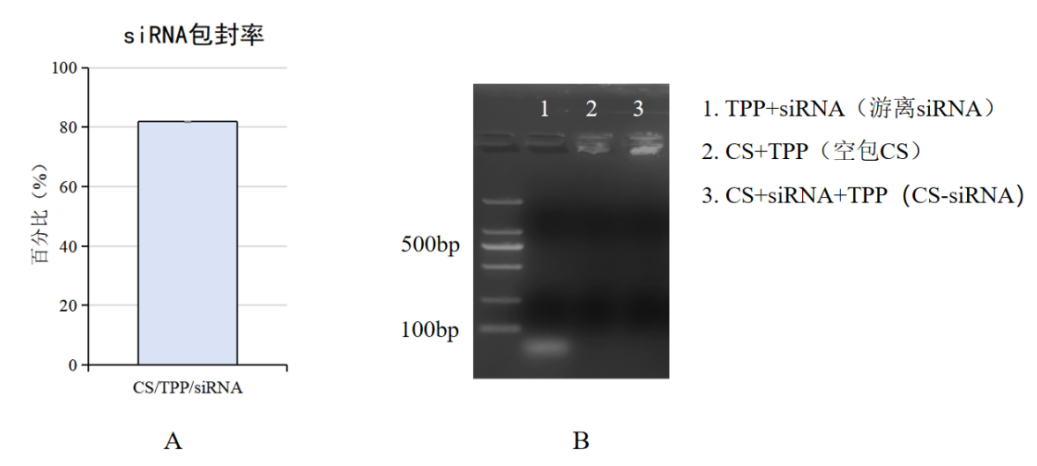
图1
图A:游离siRNA浓度检测包封率
图B:siRNA琼脂糖凝胶电泳图
实验方案:壳聚糖siRNA细胞转染以及转染效率
实验目的:
以HEK-293T-eGFP细胞为例,对壳聚糖/siRNA纳米颗粒的转染效率进行检测。
实验试剂:
细胞培养、传代、转染相关试剂、耗材、仪器。
提取RNA、RNA逆转录、实时荧光定量PCR相关试剂、耗材、仪器。
实验步骤:
1、壳聚糖/siRNA纳米颗粒的准备
将使用微流控混合方式制备的壳聚糖/siRNA纳米颗粒进行过滤除菌,利用0.22μm的滤膜进行二次过滤。
2、HEK-293T-eGFP细胞的转染
将离心消化好的HEK-293T-eGFP细胞,利用无PS的DMEM完全培养基(10%FBS+高糖DMEM)进行重悬,并稀释到105/ml的密度,以500μL/孔的体积加入24孔板内,缓慢摇匀进行铺板。
将壳聚糖/siRNA纳米颗粒以24孔板每孔500ng的量进行添加。若试用其他规格培养皿或培养板,保证包封在壳聚糖/siRNA纳米颗粒内siRNA最终浓度为1000ng/ml。
3、壳聚糖/siRNA纳米颗粒转染效率检测
以si-NC壳聚糖纳米颗粒转染作为对照组,以si-eGFP壳聚糖纳米颗粒转染作为实验组,培养48h之后提取HEK-293T-eGFP细胞RNA。进行逆转录、实时荧光定量PCR检测其中eGFP的表达量。如图1所示,与si-NC壳聚糖纳米颗粒相比,其eGFP表达量显著降低。证明壳聚糖-聚阴离子纳米颗粒可递送siRNA进入细胞内,并影响基因的表达。

图1 转染si-NC壳聚糖纳米颗粒、si-eGFP壳聚糖纳米颗粒后细胞eGFP的表达量
附录
附件清单:
附件一 双水相混合液中试剂相关配比对CS/TPP NPs粒径/PDI的影响
1、水相1的醋酸浓度=pH值对CS/TPP NPs合成粒径/PDI的影响
2、水相2中吐温80(Tween 80)的体积比例对CS/TPP NPs合成粒径/PDI的影响
3、水相1、2中,TPP或CS的比例变化对CS/TPP NPs合成粒径/PDI的影响
4、水相1、2中CS/TPP比例不变,浓度改变对CS/TPP NPs合成粒径/PDI的影响
附件二 试剂保质期及温度对CS/TPP NPs粒径/PDI的影响
1、TPP试剂保质期
2、CS试剂保质期
3、试剂温度的影响
附件三 微流控参数对CS/TPP NPs粒径/PDI的影响
1、流速比对CS/TPP NPs合成粒径/PDI的影响
2、流体动力学对CS/TPP NPs合成粒径/PDI的影响的证据
附件四 初产物过滤对CS/TPP NPs粒径/PDI的影响
1、初产物过滤前后的影响
2、过滤与稀释检测的顺序
附件五 产物检测稀释浓度对CS/TPP NPs粒径/PDI的影响
附件六 siRNA对CS/TPP NPs粒径/PDI的影响
附件七 产物储存条件对CS/TPP NPs粒径/PDI的影响
附件一 、水相混合液中试剂相关配比对CS/TPP NPs粒径/PDI的影响
1、水相1的醋酸浓度(pH)值对CS/TPP NPs合成粒径/PDI的影响
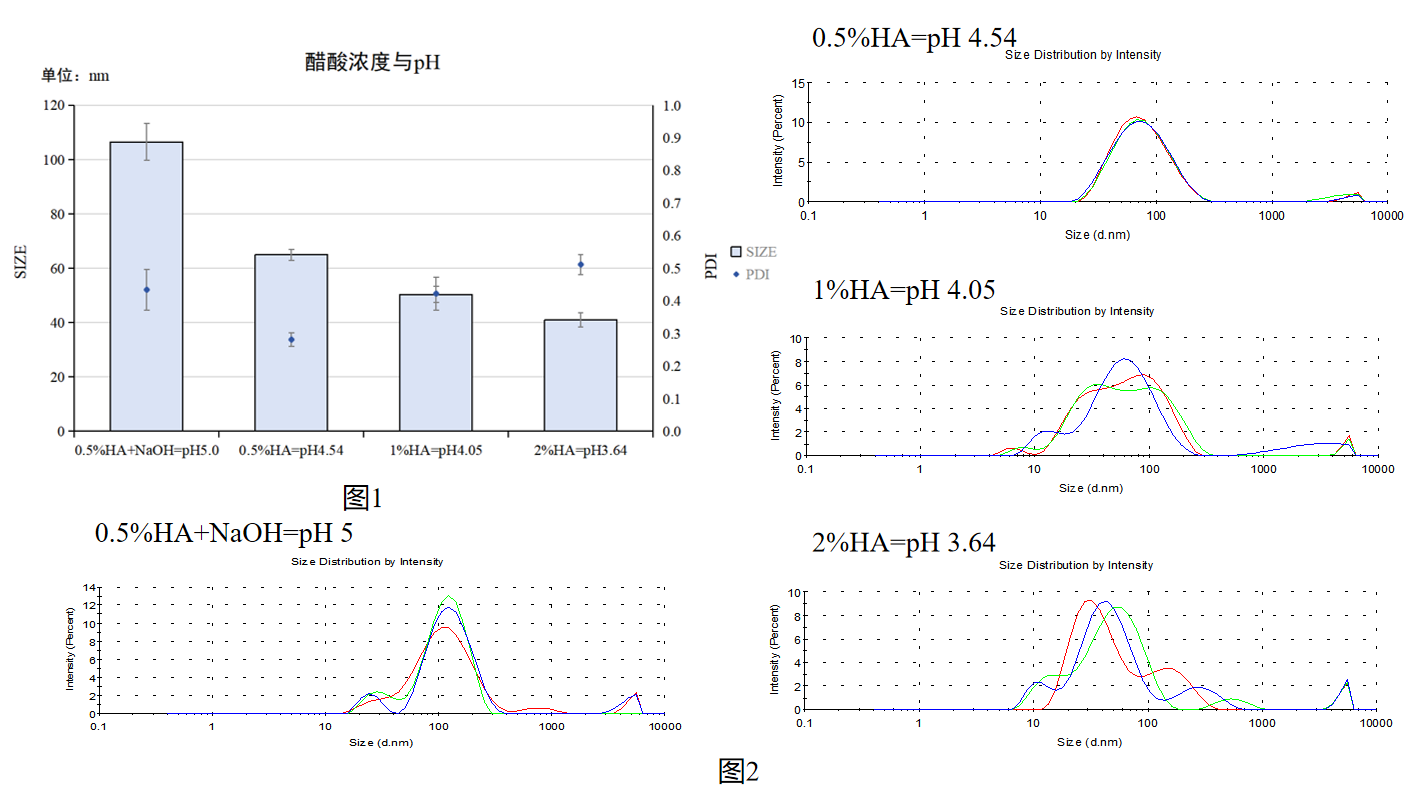
图1:水相1醋酸浓度=pH值与CS/TPP NPs粒径/PDI关系统计图
图2:水相1醋酸浓度=pH值影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:
(1)0.5%HA+NaOH=pH 5:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸+1M NaOH
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(2)0.5%HA=pH 4.54:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(3)1%HA=pH 4.05:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 1%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(4)2%HA=pH 3.64:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 2%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80/
微流控参数:流速(TFR):16mL/min;
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:醋酸浓度升高即pH变低之后,CS/TPP NPs粒径变小,但是PDI数值均大于0.5%(pH=4.54);1%HA(pH=4.05)、2%HA(pH=3.64)、0.5%HA+NaOH(pH=5)的粒径分布峰图变得十分杂乱;0.5%HA(pH=3.64)峰图相较单峰且均一。
实验结论:建议采用0.5%醋酸浓度即pH为4.54时,进行CS/TPP NPs合成
2、水相2中吐温80(Tween 80)的体积比例对CS/TPP NPs合成粒径/PDI的影响
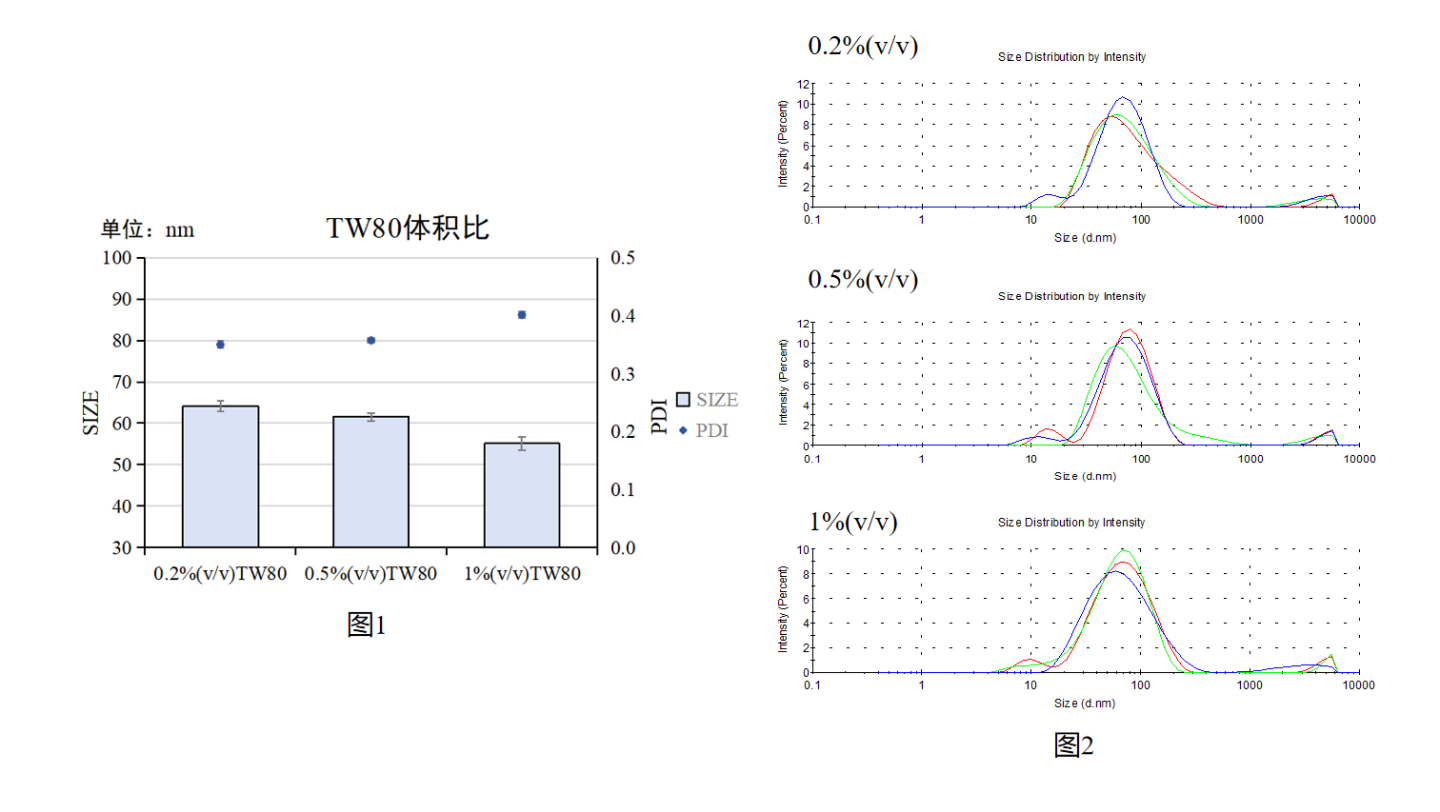
图1:吐温80与CS/TPP NPs粒径/PDI关系统计图
图2:吐温80影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:
(1)0.2%(v/v)TW80:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.2%(v/v)吐温80
(2)0.5%(v/v)TW80:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(3)1%(v/v)TW80:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+1%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:随着Tween80体积比的增加,粒径逐渐减小,但PDI逐渐增大,0.5%与0.2%(v/v)TW80结果相似,但0.5%(v/v)TW80粒径更小一点;1%(v/v)TW80,NPs粒径变小,但PDI数值增大,三者的峰图没有显著差异。
实验结论:建议采用0.5%(v/v)吐温80进行CS/TPP NPs合成。
3、水相1、2中,TPP或CS的比例变化对CS/TPP NPs合成粒径/PDI的影响
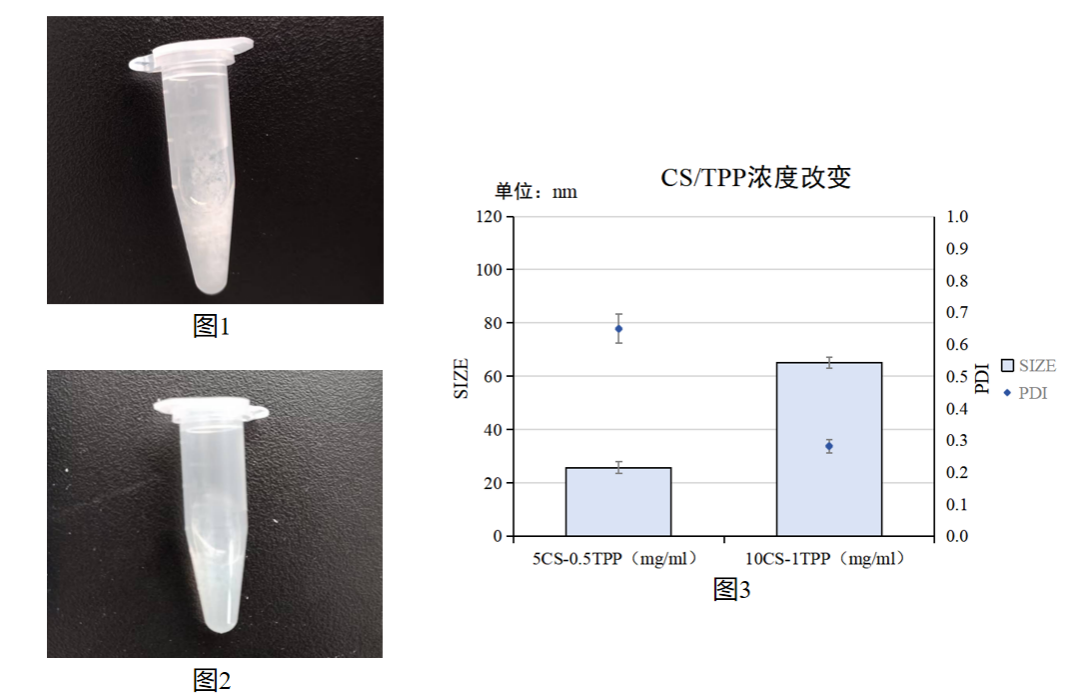
图1:试剂浓度(1)CS/TPP NPs产物拍摄实物图
图2:试剂浓度(2)CS/TPP NPs产物拍摄实物图
图3:CS/TPP浓度与CS/TPP NPs粒径/PDI关系统计图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:
(1)10CS-2TPP:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(2mg/mL)+0.5%(v/v)吐温80
(2)5CS-1TPP:水相1-壳聚糖(CS)溶液:壳聚糖(5mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(3)5CS-0.5TPP:水相1-壳聚糖(CS)溶液:壳聚糖(5mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(0.5mg/mL)+0.5%(v/v)吐温80
(4)10CS-1TPP:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:按照CS:TPP=1:5的比例、两个不同浓度的合成的CS/TPP NPs都是浑浊且含有絮状沉淀,不能合成CS/TPP NPs纳米颗粒;按照CS:TPP=1:10的比例两个不同浓度的合成的CS/TPP NPs,粒径都较小,但粒径小的PDI较高。
实验结论:建议使用TPP与CS浓度比为1:10的比例进行后续的实验。
4、水相1、2中CS/TPP比例不变,浓度改变对CS/TPP NPs合成粒径/PDI的影响
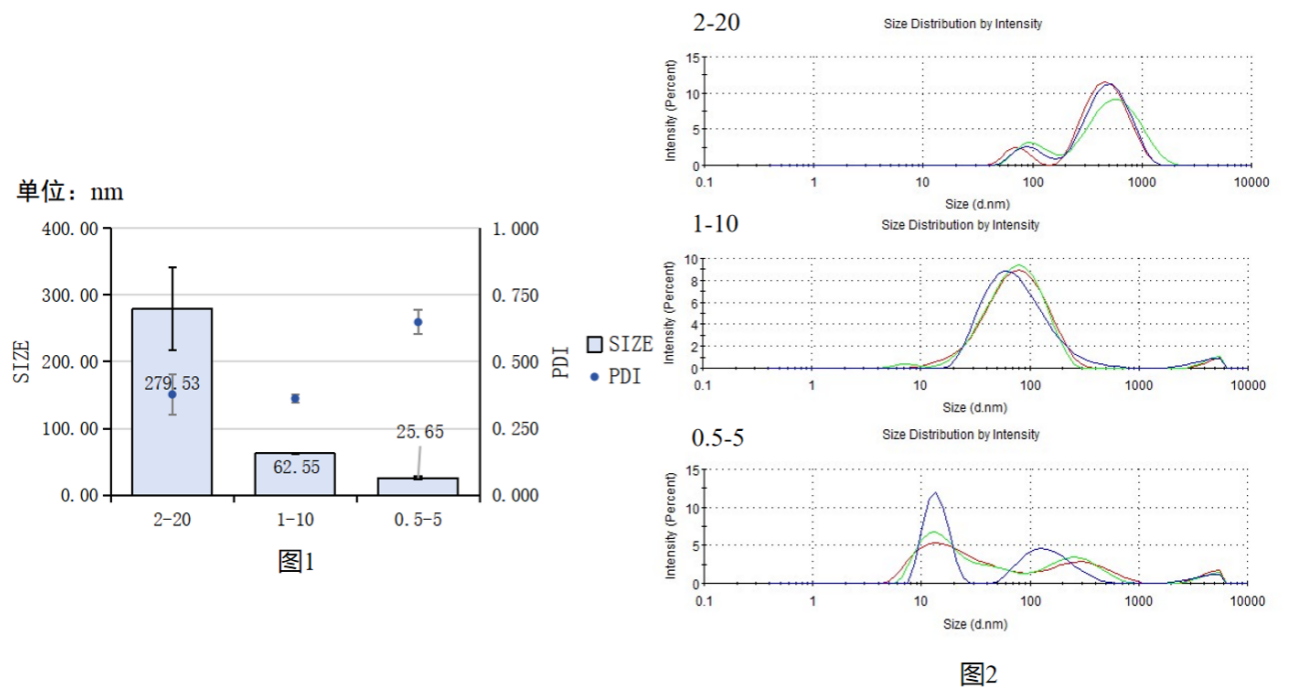
图1:CS/TPP浓度与CS/TPP NPs粒径/PDI关系统计图
图2:CS/TPP浓度影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:
(1)2-20:水相1-壳聚糖(CS)溶液:壳聚糖(20mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(2mg/mL)+0.5%(v/v)吐温80
(2)1-10:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(3)0.5-5:水相1-壳聚糖(CS)溶液:壳聚糖(5mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(0.5mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:2-20的浓度合成的CS/TPP NPs粒径较大约280nm ,PDI约为0.4,峰图具有双峰曲线,均一性较差;1-10的浓度合成的CS/TPP NPs粒径约62.55nm ,PDI约为0.4,峰图具有单峰曲线均一性较好;0.5-5的浓度合成的CS/TPP NPs粒径较小约25.65,但PDI偏大约为0.6左右,且峰图杂乱。
实验结论:建议使用浓度为1mg/mL TPP与10mg/mL CS进行后续的实验。
附件二、 试剂保质期及温度对CS/TPP NPs粒径/PDI的影响
1、TPP试剂保质期

图1:TPP保质期与CS/TPP NPs粒径/PDI关系统计图
图2:TPP保质期影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:CS/TPP均使用4天前的试剂,PDI数值、NPs粒径与现配试剂结果类似,但粒径分布图多峰杂乱;只TPP使用4天前试剂,PDI数值、NPs粒径均增大,峰图杂乱结果不可靠;都使用现配试剂,PDI数值、NPs粒径、峰图结果为较好单峰。
实验结论:TPP试剂保存期限目前2天内可以正常使用,但是建议现配现用,排除无关变量影响。
2、CS试剂保质期

图1:CS保质期与CS/TPP NPs粒径/PDI关系统计图
图2:CS保质期影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:CS使用4天前的试剂,PDI数值、NPs粒径、峰图与现配试剂结果类似;只TPP使用4天前试剂,PDI数值、NPs粒径均增大,峰图杂乱结果不可靠。
实验结论:CS试剂保存期限目前4天内可以正常使用,但是建议现配现用,排除无关变量影响
3、试剂温度的影响

图1:试剂温度与CS/TPP NPs粒径/PDI关系统计图
图2:试剂温度影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:随着温度提高,CS/TPP NPs的粒径会增大,PDI随之减小;结合粒径分布曲线观察,其中常温的合成条件峰图曲线较窄,为单峰曲线,4度和60度的试剂合成温度,曲线杂乱,且非单峰。
实验结论:CS/TPP NPs的合成所需试剂需要恢复至室温使用。
附件三 、微流控参数对CS/TPP NPs粒径/PDI的影响
1、流速比对CS/TPP NPs合成粒径/PDI的影响

图1:只改变CS流速比与CS/TPP NPs粒径/PDI关系统计图
图2:只改变TPP流速比与CS/TPP NPs粒径/PDI关系统计图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水)=如图1、2横坐标所示
实验结果:只改变CS流速比,TPP比例恒为1时,合成的CS/TPP NPs的粒径较大,均大于100nm,随着CS流速比的降低,CS/TPP NPs的粒径变小;只改变TPP流速比,CS比例恒为1时,CS/TPP NPs的粒径与PDI变小,其中流速比为1:3时粒径最小,且PDI数值也较小。
实验结论:在该实验条件下,CS与TPP水溶液的流速比使用1:3的流速比合成CS/TPP NPs的粒径与PDI较好。
2、流体动力学对CS/TPP NPs合成粒径/PDI的影响的证据

图1:流体动力学参数与CS/TPP NPs粒径/PDI关系统计图
图2:流体动力学参数影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度与微流控参数:
- FRR=1:3-10CS-1TPP(mg/mL):
水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
(2)FRR=1:1-5CS-1.5TPP(mg/mL):
水相1-壳聚糖(CS)溶液:壳聚糖(5mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1.5mg/mL)+0.5%(v/v)吐温80
流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:1
实验结果:当配方(1)流速比不同,分别为水相1(CS):水相2(TPP)=1:3和配方(2)水相1(CS):水相2(TPP)=1:1;两种配方试剂终浓度相同,均为2.5mg/mL的CS及0.75mg/mL的TPP时。两种配方合成的CS/TPP NPs粒径具有显著性差异,但两者PDI差异不明显。
实验结论:CS/TPP NPs的合成本质是动态流动控制的反应过程,并非是一个静态合成的过程,并且该形成过程受流体动力学参数的显著影响。
附件四、 初产物过滤对粒径/PDI的影响
1、初产物过滤前后的影响

图1:0.22μm PTFE滤膜过滤前后CS/TPP NPs粒径/PDI关系统计图
图2:过滤前后影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:0.22μm PTFE滤膜过滤初产物后,CS/TPP NPs的粒径、PDI数值变小。结合粒径分布峰图观察,大于1μm的杂峰消失,count rate略微下降。
2、过滤与稀释检测的顺序

图1:过滤与稀释顺序与CS/TPP NPs粒径/PDI关系统计图
图2:过滤与稀释顺序影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水)=1:3
过滤流程:
1、初产物先利用去离子水进行1:1稀释,再利用0.22μm PTFE滤膜过滤,吸取滤后产物1mL直接检测。
2、初产物先利用0.22μm PTFE滤膜过滤,吸取滤后产物500μL,再利用去离子水进行1:1稀释检测。
实验结果:初产物过滤后,减小CS/TPP NPs粒径与PDI,粒径分布峰图变为均一单峰;先加去离子水1:1稀释初产物,然后过滤;与先过滤初产物后加去离子水1:1稀释没有显著差异,两者粒径均减小。
实验结论:先稀释过滤或后稀释过滤都可以,但推荐初产物合成后首先过滤,再进行稀释检测,以保持初产物的浓度。
附件五 、产物检测稀释倍数对CS/TPP NPs粒径/PDI的影响
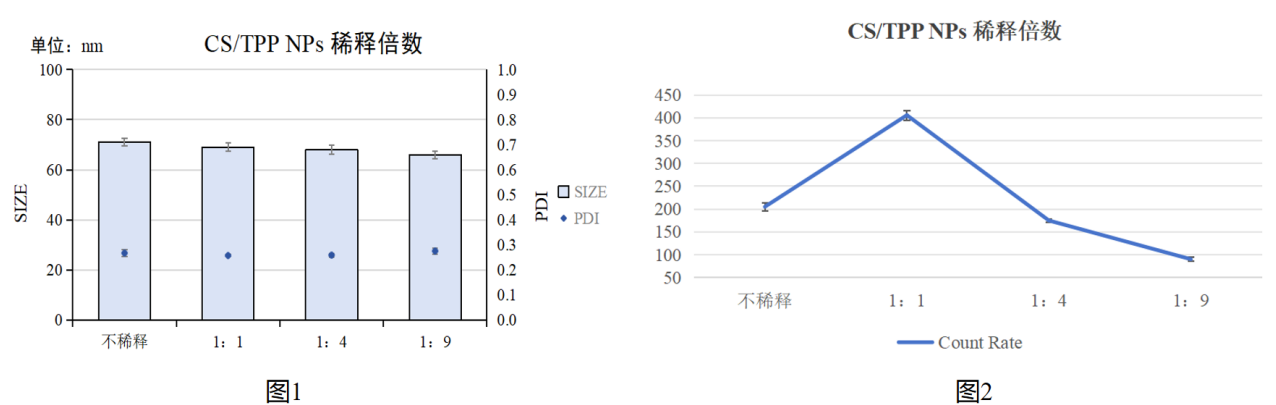

图1:产物检测稀释比例与CS/TPP NPs粒径/PDI关系统计图
图2:产物检测稀释比例与CS/TPP NPs检测count rate数值的关系
图3:稀释比例影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水)=1:3
实验结果:进行不同比例稀释后CS/TPP NPs的粒径大小略微减小,但无显著差异,PDI各组之间也无显著差异;但是按照不同比例稀释后count rate 具有显著性差异,其中1:1稀释比的count rate 数值更高,检测结果相对更可靠;粒径分布峰图显示,相比于其他稀释比的粒径分布图,1:1的稀释比的峰图更均一。
实验结论:推荐产物:去离子水=1:1稀释比例利用动态光散射仪检测CS/TPP NPs。
附件六、siRNA对CS/TPP NPs粒径/PDI的影响

图1:siRNA影响CS/TPP NPs粒径/PDI关系统计图
图2:siRNA影响CS/TPP NPs粒径分布峰图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:
(1)空包:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80
(2)siRNA:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相3-siRNA溶液:TPP(1mg/mL)+0.5%(v/v)吐温80+siRNA(30ng/μL)
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相3(水)=1:3
实验结果:空包与siRNA的粒径与PDI没有显著性差异,粒径都在60nm左右,;两者的粒径与PDI分布峰图也较为均一,为单峰曲线,没有显著性差异。
实验结论:空包的CS/TPP NPs与CS/TPP-siRNA NPs的粒径与PDI没有显著差异,粒径都偏小且均一,siRNA对壳聚糖纳米颗粒的粒径影响不显著。
附件七、 产物储存条件对CS/TPP NPs粒径/PDI的影响

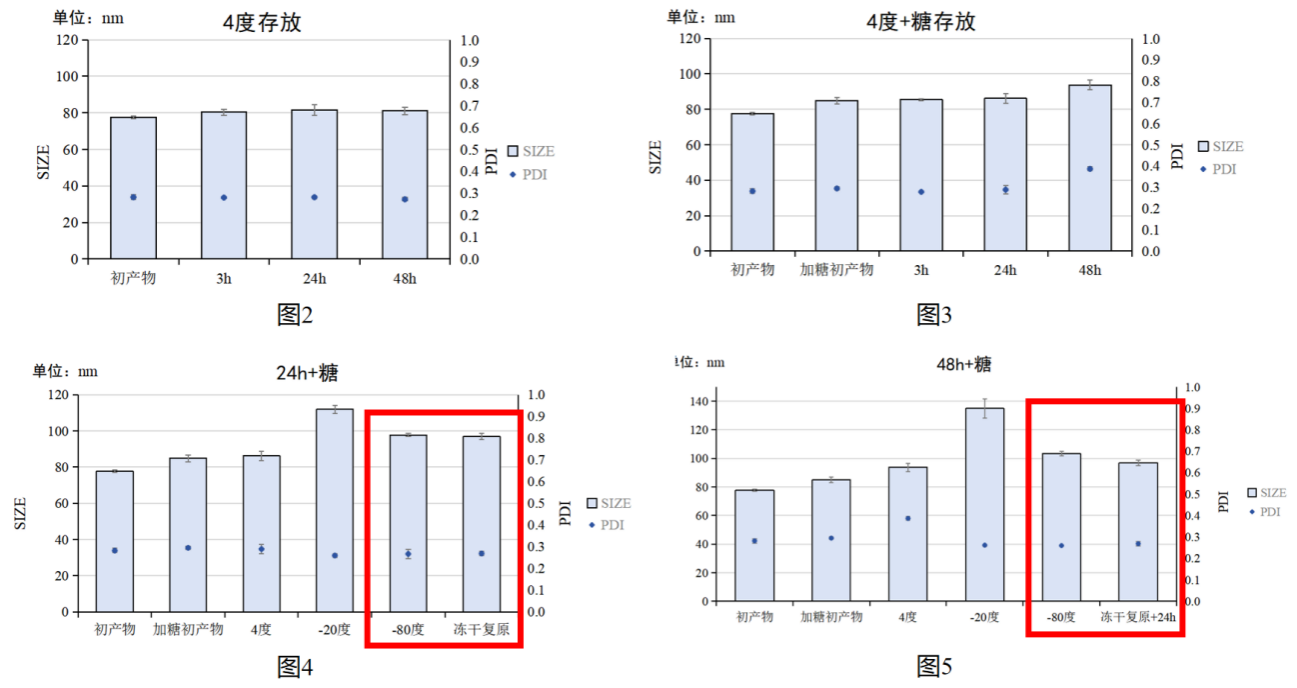
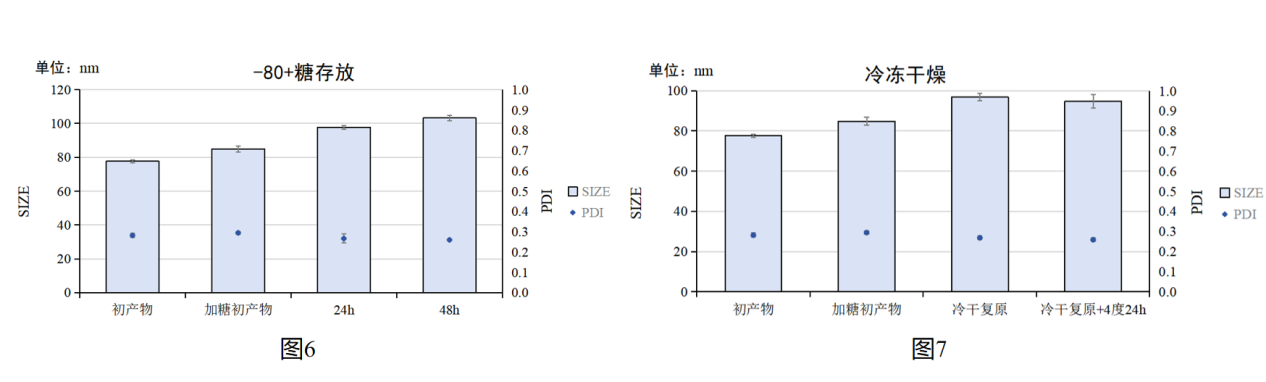
图1:冷冻保护剂对CS/TPP NPs影响实物图,其中+糖为添加保护剂的组别
图2:4度储存时间与CS/TPP NPs粒径/PDI关系统计图
图3:添加冷冻保护剂(5%w/v蔗糖),4度储存时间与CS/TPP NPs粒径/PDI关系统计图
图4:添加冷冻保护剂(5%w/v蔗糖),24h时不同储存方法与CS/TPP NPs粒径/PDI关系统计图
图5:添加冷冻保护剂(5%w/v蔗糖),48h时不同储存方法与CS/TPP NPs粒径/PDI关系统计图
图6:添加冷冻保护剂(5%w/v蔗糖),-80度储存时间与CS/TPP NPs粒径/PDI关系统计图
图7:添加冷冻保护剂(5%w/v蔗糖),冷冻干燥复原与CS/TPP NPs粒径/PDI关系统计图
实验条件:仪器:FluidicLab-NP-S2;芯片:FluidicLab-C2
试剂浓度:水相1-壳聚糖(CS)溶液:壳聚糖(10mg/mL)+ 0.5%醋酸
水相2-三聚磷酸钠(TPP)溶液:TPP(1mg/mL)+0.5%(v/v)吐温80=
微流控参数:流速(TFR):16mL/min
流速比(FRR):水相1(脂):水相2(水) =1:3
实验结果:不添加冷冻保护剂(5%w/v蔗糖),进行-20度、-80度冻存会导致CS/TPP NPs变为浑浊不透明状态。并且不添加冷冻保护剂冷冻干燥后,会导致不能复溶重悬,均无法再测量CS/TPP NPs粒径与PDI(图1);4度短期储存时,在48h内不添加冷冻保护剂时,CS/TPP NPs的粒径与PDI基本没有变化,添加后会使粒径增大(图2-3)。在添加冷冻保护剂储存24h和48h时间点,所有储存方法CS/TPP NPs的粒径与PDI都会增大;不同储存方法中,-20度储存会导致CS/TPP NPs的粒径与PDI显著增大,但-80度和冷冻干燥方法结果相差不大,其中冷冻干燥复原后CS/TPP NPs的粒径与PDI更小一点(图4-7)。
实验结论:短期(48h内)时间,滤后的初产物直接储存在4度可以保持CS/TPP NPs的稳定性。对于长期保存,推荐添加5%w/v蔗糖作为冷冻保护剂,进行冷冻干燥储存,复溶后短期可以储存在4度。





























![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)



