基于微流控技术的甲基丙烯酰化透明质酸(HAMA)水凝胶因其独特的生物相容性、可调控的物理化学性质及智能响应性,在生物医学领域展现出巨大的应用潜力。HAMA水凝胶通过微流控技术可实现精准结构设计与功能化修饰,构建多功能递送系统,为组织修复、炎症调控及代谢疾病治疗提供了创新解决方案。本文综述了近三年来基于微流控技术的HAMA水凝胶前沿应用,为生物医学材料设计与疾病治疗提供新思路。
1.组织系统修复与再生
1.1 化疗后卵巢功能损伤的修复策略
化疗所致卵巢早衰(POF)严重威胁女性生育能力,尽管激素替代疗法和干细胞手段(如人脐带间充质干细胞(hUC-MSCs)衍生的外泌体)展现修复潜力,但其疗效局限与安全伦理争议促使临床亟待开发新型治疗策略。
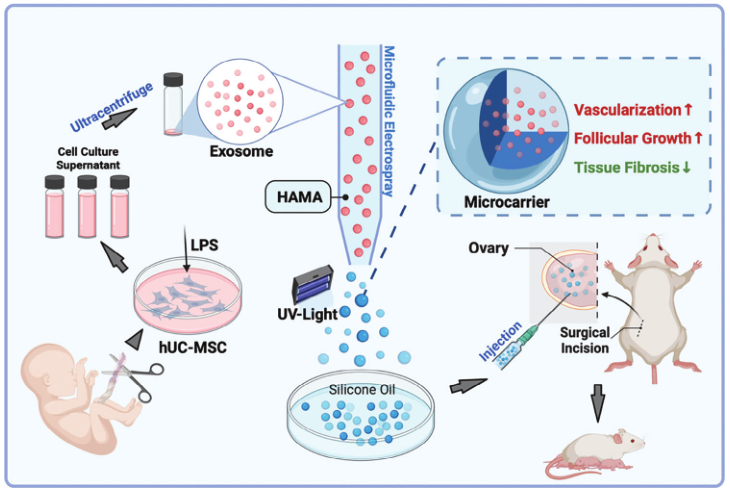
基于上述问题,南京大学孙海翔教授团队首次提出了一种基于微流控技术的新型外泌体递送系统用于卵巢修复。该体系首先利用脂多糖(LPS)预激活hUC-MSCs增强其分泌外泌体的活性,然后利用微流控电喷雾技术将所得外泌体封装于HAMA微载体中,形成粒径均一(~200μm)的可注射微球。该体系具有以下优势:一、借助HAMA的半透性实现外泌体缓释(持续14 d)和局部滞留;二、LPS预激活使外泌体富含促血管生成(VEGF)和抗纤维化蛋白(TIMP-1);三、微流控技术确保载体的单分散性和批次稳定性。在POF小鼠模型中,卵巢原位注射显著改善激素水平、卵泡储备(原始卵泡增加3倍)及生育力(产仔数恢复至正常组85%)。
该系统突破传统干细胞治疗局限,结合HAMA的生物相容性低免疫原性优势,首次构建外泌体-水凝胶复合递送体系,为化疗后卵巢功能恢复提供兼具安全性和有效性的治疗新策略。
参考文献:Microfluidic encapsulation of exosomes derived from lipopolysaccharide-treated mesenchymal stem cells in hyaluronic acid methacryloyl to restore ovarian function in mice
期刊(年份):Advanced Healthcare Materials (2024)
来源:https://advanced.onlinelibrary.wiley.com/doi/abs/10.1002/adhm.202303068
1.2 急性肝功能衰竭的干预策略
急性肝衰竭(ALF)严重威胁生命,尽管人诱导多能干细胞衍生的肝细胞(hiPSC-heps)因其高效分化能力和卓越的肝功能表现被视为最具前景的细胞治疗方案,但传统静脉注射递送存在免疫排斥、分散移植难以重建功能性肝微环境以及受损肝脏的缺血缺氧微环境等问题,严重制约其治疗效果。因此,临床亟需开发新型递送系统以规避免疫清除、实现精准定位并优化微环境适配。
基于上述问题,东南大学赵远锦教授团队首次提出了一种基于微流控技术的仿生血管化iPSC-肝细胞球体递送系统,用于ALF的再生治疗。该系统通过微流控精准调控构建核壳结构微胶囊(以羧甲基纤维素(CMC)负载hiPSC-肝细胞为核心(200 μm),以海藻酸盐/HAMA(Na-Alg/HAMA)混合水凝胶为壳层(358 μm))。该体系具有以下优势:一、选择性降解Na-Alg形成的多孔HAMA壳层(孔径15 μm)促进人脐静脉内皮细胞(HUVECs)构建血管网络,模拟肝脏生理结构;二、人脐静脉内皮细胞(HUVECs)与hiPSC-肝细胞的空间交互显著提升肝特异性功能;三、血管网络既提供营养支持又形成免疫屏障。
该系统突破传统细胞移植的免疫排斥和营养供给障碍,通过微胶囊的免疫屏障功能、血管化网络的营养支持及旁分泌效应协同实现高效肝再生,为ALF治疗提供兼具功能重建与免疫保护的新型策略。
参考文献:Biomimetic vascularized iPSC-Hepatocyte spheroids for liver regeneration
期刊(年份):Advanced Science (2025)
来源:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202405662
1.3 骨再生修复策略
创伤性骨缺损严重威胁患者肢体功能,尽管自体/异体骨移植和生长因子(血管内皮生长因子(VEGF)和骨形态发生蛋白2(BMP2))递送支架临床展现出修复潜力,但受来源限制、疾病传播及免疫排斥制约,亟需开发新型生物材料策略。现有技术难以同时满足血管期(0-2周)与成骨期(2-8周)的时序性生长因子需求(VEGF半衰期<6小时,BMP2需持续释放4周以上),且复杂制备工艺导致支架生物相容性降低(炎症因子IL-6升高3-5倍)。因此,开发智能释放仿生支架成为突破方向。
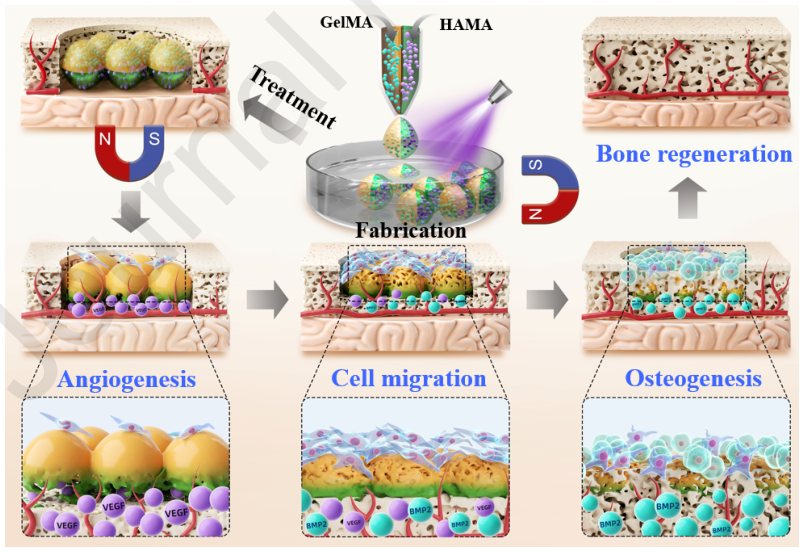
针对上述问题,东南大学赵远锦教授团队提出了一种基于微流控技术的仿生Janus双面微载体递送系统。该系统通过微流控技术构建双半球结构(HAMA半球负载VEGF,GelMA半球负载BMP2),并掺杂磁性Fe3O4@SiO2纳米颗粒实现术中精准定位。该体系具有以下优势:一、利用HAMA(低交联)和GelMA(高交联)的差异降解特性,实现VEGF快速释放(6 d释放80%)与BMP2缓释(持续14 d)的时序匹配;二、磁性纳米颗粒赋予微球(粒径150 μm)精准定位能力,缺损部位富集效率提升3倍;三、GelMA半球的RGD序列促进细胞粘附(粘附率>90%),HAMA半球减少组织粘连(纤维化面积降低60%)。
该系统突破传统载体单一释放模式,通过智能顺序递送和磁控靶向,结合材料生物相容性优势,为复杂骨缺损提供兼具时空精准性和功能协同性的治疗新策略。
参考文献:Bio-inspired Janus microcarriers with sequential actives release for bone regeneration
期刊(年份):Chemical Engineering Journal (2023)
来源:https://www.sciencedirect.com/science/article/abs/pii/S1385894723055286
1.4 皮肤伤口愈合修复策略
皮肤作为人体重要屏障,受损后伤口易暴露感染,从而导致愈合时间延长。因此,慢性不愈合伤口是重大临床挑战,给患者和社会带来沉重负担。当前虽能控制感染可促进愈合,但抗生素滥用致细菌耐药,因此亟待开发新型抗菌剂敷料以应对此问题。
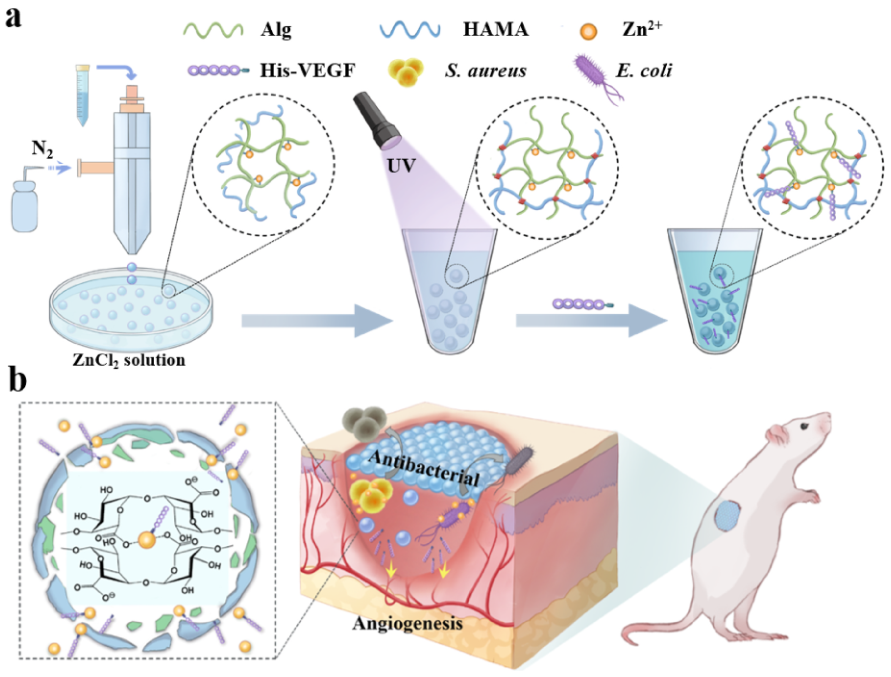
基于上述问题,中南大学方柏荣等提出了一种基于Zn2+双交联策略的复合多糖水凝胶微球(MS@His-VEGF)用于感染性伤口协同治疗。该技术通过气体辅助微流控技术制备微球,将藻酸盐的锌离子交联与HAMA光交联相结合,构建双交联网络结构微球(粒径230 μm)。Zn2+既稳定微球又实现His-VEGF长效缓释(持续7 d,释放率>60%),还发挥抗菌抗炎作用。在感染性伤口模型中,该微球显著促进血管生成(CD31+血管密度增加2倍)、加速伤口闭合(愈合时间缩短40%),并同步抑制炎症反应(TNF-α表达下降65%)。
该技术突破传统敷料局限,结合双交联策略与多功能协同设计优势,首次构建兼具高效药物控释、抗菌抗炎与促愈合功能的智能伤口敷料体系,为慢性难愈性伤口治疗提供新策略 。
参考文献:Zn2+ incorporated composite polysaccharide microspheres for sustained growth factor release and wound healing
期刊(年份):Materials Today Bio (2023)
来源:https://www.sciencedirect.com/science/article/pii/S2590006423001990
2.炎症调控与免疫治疗
2.1 椎间盘炎性微环境调节
椎间盘变性(IVDD)引发的炎症微环境破坏椎间盘营养平衡,导致细胞外基质代谢失衡及疝出疼痛。尽管拮抗剂注射(如IL-1Ra靶向阻断IL-1β信号)展现抗炎潜力,但半衰期短及载体材料缺陷限制疗效。临床亟待开发长效缓释系统,以稳定拮抗剂局部浓度,阻断炎症级联并逆转椎间盘退变进程。
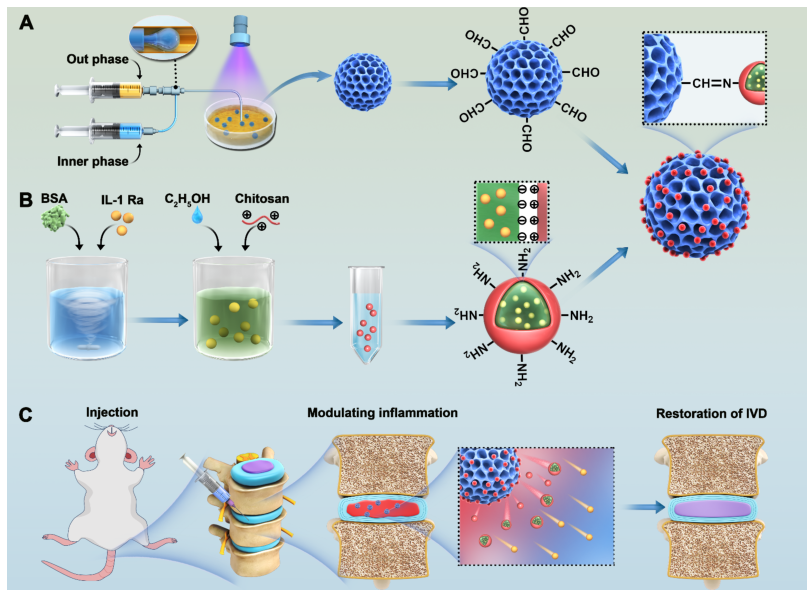
针对上述问题,南京医科大学农鲁明教授团队开发了一种pH响应型HAMA微球递药系统,用于对IVDD微环境调节。该系统通过微流控技术制备醛基化HAMA微球(AHAMA),并利用席夫碱反应将负载IL-1受体拮抗剂(IL-1 Ra)的白蛋白纳米颗粒(BNP)固定于微球表面,形成智能释放的复合微球(Modified MS)。该体系具有以下优势:一、酸性微环境(pH 6.5)下,触发席夫碱键断裂,实现IL-1 Ra的靶向缓释(28 d释放74.93%);二、BNP共价固定避免椎间盘高压导致的药物泄漏;三、HAMA的ECM仿生特性为髓核细胞提供适宜微环境。在IVDD大鼠模型中,该系统显著抑制炎症因子,促进ECM再生,并恢复椎间盘高度。
该系统首创pH响应性靶向递药机制,通过微流控结合化学键合技术提升载药效率,并达到抗炎-促再生双效治疗策略,为IVDD微创干预提供安全高效的新方案。
参考文献:pH-responsive modified HAMA microspheres regulate the inflammatory microenvironment of intervertebral discs
期刊(年份):ACS Applied Materials Interfaces (2024)
来源:https://pubs.acs.org/doi/full/10.1021/acsami.4c14475
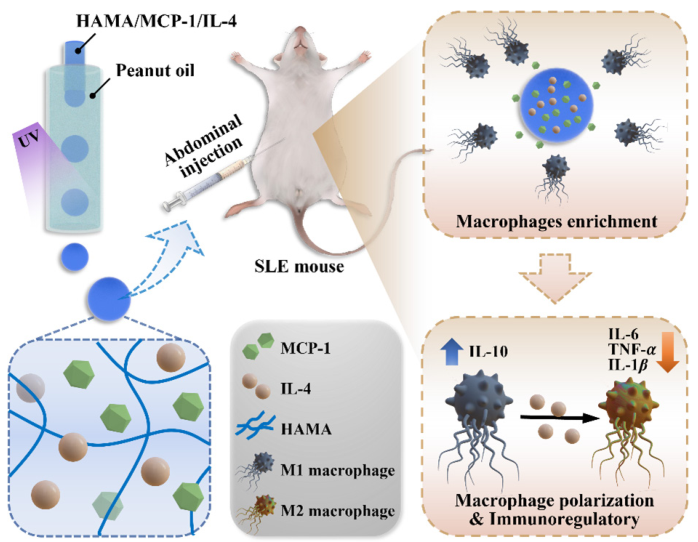
2.2 系统性红斑狼疮(SLE)的精准免疫治疗
系统性红斑狼疮(SLE)作为一种常见的致命性自身免疫性疾病,其核心病理表现为B/T细胞异常活化及对自身抗原的免疫耐受性崩溃。而巨噬细胞通过调节免疫稳态在SLE的发病机制中发挥至关重要作用。现有地塞米松等药物虽能干预巨噬细胞功能,但单药刺激效率不足且存在代谢过快缺陷。基于药物递送效率与靶向性的双重瓶颈,开发新型纳米封装策略已成为突破现有治疗困境的重要方向。
针对上述问题,东南大学赵远锦教授团队首次提出了一种基于HAMA的智能水凝胶微粒递药系统用于SLE治疗。该系统通过微流控技术制备共载单核细胞趋化蛋白-1(MCP-1)和白细胞介素-4(IL-4)双因子的均一多孔HAMA的微粒(粒径180-450 μm),实现巨噬细胞功能的有效调控从而缓解疾病。该体系具有以下优势:一、利用HAMA多孔结构实现双因子缓释(28 d释放75%IL-4),MCP-1优先释放募集巨噬细胞(迁移率提升5倍),IL-4后续诱导M2型极化(CD206表达上调3倍);二、微流控技术确保微粒均一性和高载药效率(28%)。在SLE模型小鼠中,该系统显著降低抗dsDNA抗体水平(下降60%)、改善肾脏病理(IgG沉积减少70%),并重塑免疫平衡(IL-10/TGF-β分泌增加2倍)。
该系统实现“先富集后调控”的精准巨噬细胞管理,具有pH响应性,可局部靶向递送,打破SLE自身免疫恶性循环,为SLE精准免疫治疗提供创新方案,具重要科学价值与应用前景。
参考文献:MCP-1 and IL-4 encapsulated hydrogel particles with macrophages enrichment and polarization capabilities for systemic lupus erythematosus treatment
期刊(年份):Nano Research (2024)
来源:https://link.springer.com/article/10.1007/s12274-024-6794-z
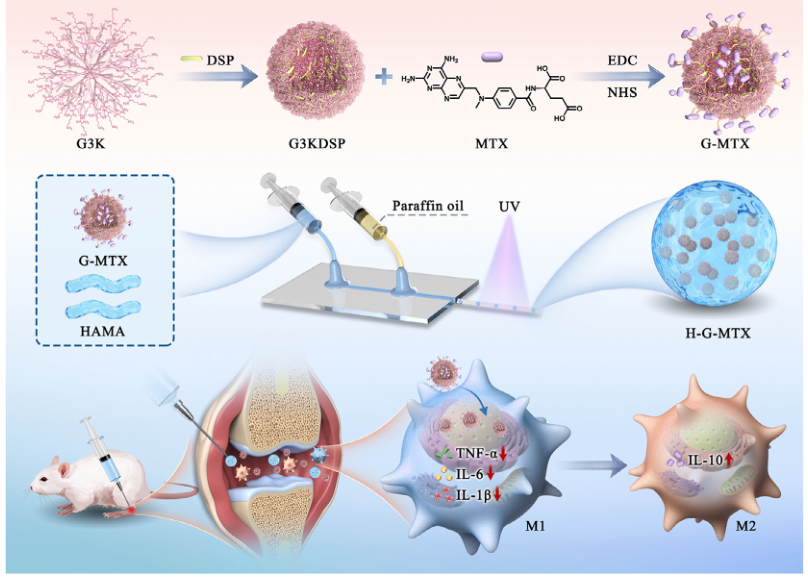
2.3 类风湿性关节炎治疗
类风湿性关节炎(RA)是一种慢性自身免疫性疾病,以关节破坏和疼痛为特征,患者需长期治疗。甲氨蝶呤(MTX)凭借其免疫调节特性被确立为临床一线基础用药,但传统全身给药模式受制于生物利用度低和系统性毒副作用的双重限制。当前基于纳米载体的局部靶向策略虽可提高病灶药物浓度,但细胞内递送效率低,且在炎症环境中代谢快、停留时间短等问题。因此,开发兼具炎症响应释药特性、胞内递送效率及关节靶向稳定性的新型智能递送系统,已成为突破现有治疗瓶颈的关键研究方向。
针对上述问题,东南大学赵远锦教授团队提出了一种用于治疗RA的分层微纳药物递送系统(H-G-MTX)。该系统通过微流控技术将共价MTX的肽树枝状大分子纳米颗粒(G-MTX)封装于粒径均一的HAMA微球(145±25 μm)中,形成“微-纳”协同递送体系。纳米级G-MTX通过电荷相互作用清除炎症因子,同时促进巨噬细胞表型转化(M1→M2),双重机制协同抑制炎症;微米级HAMA微球利用半透膜特性延长关节腔滞留时间(时间延长3倍),并在炎症酸性微环境触发响应性降解,实现药物缓释。通过微流控技术实现微球尺寸和内部孔隙结构的精准控制,提高载药效率和批次一致性。
该研究为RA治疗提供高效、安全的新策略,并可能拓展至其他自身免疫性疾病。
参考文献:Hierarchical microcarriers loaded with peptide dendrimer-grafted methotrexate for rheumatoid arthritis treatment
期刊(年份):Small Science (2024)
来源:https://onlinelibrary.wiley.com/doi/full/10.1002/smsc.202300097
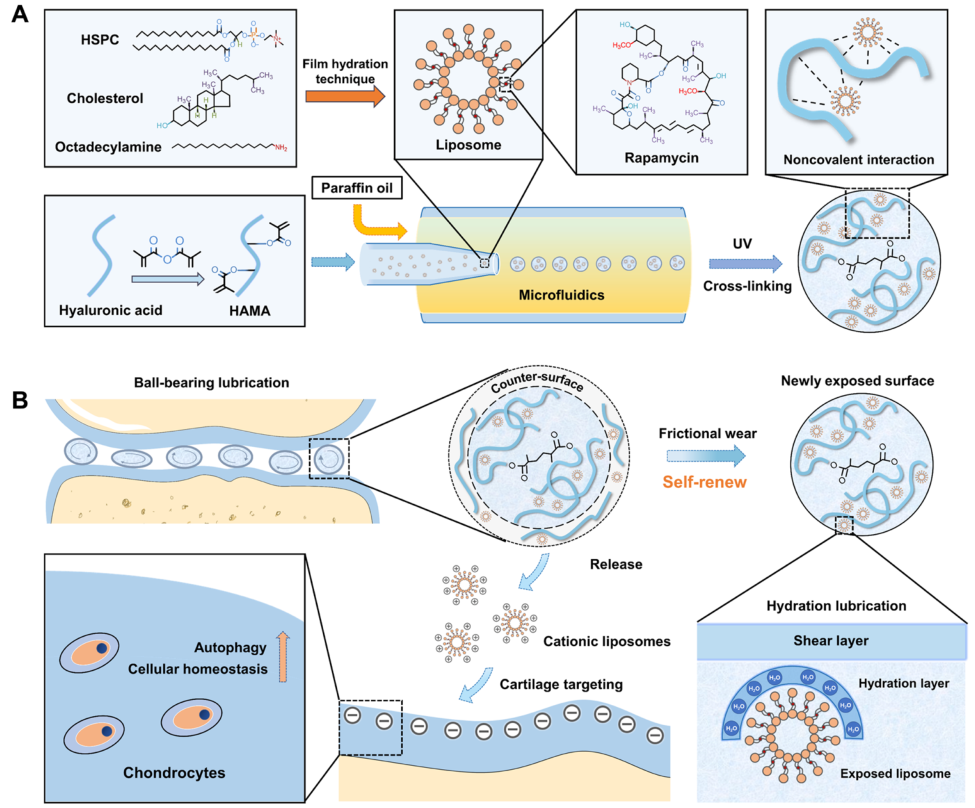
2.4 关节炎的缓解与治疗
骨关节炎(OA)是一种以关节摩擦增加、软骨损伤、滑液润滑减少和关节炎症为特征的退行性关节疾病,全球患者不低于2.4亿。其早期阶段,关节内的滑膜和软骨产生促炎因子致软骨损伤和关节破坏。现有药物和手术仅能缓解症状,且存在生物利用度低、副作用大及无法再生软骨等局限。此外,近年来干细胞疗法已成为 OA 治疗的有前途的替代方案,但受限于存活率、免疫排斥及伦理争议,因此,亟待开发新型治疗策略。
基于上述关节磨损问题,重庆医科大学黄伟教授团队提出了一种可注射水凝胶微球(RAPA@Lipo@HMs)用于骨关节炎治疗的新技术。该体系通过微流控技术将雷帕霉素(RAPA)负载的阳离子脂质体与HAMA基质结合,经光聚合形成粒径均一(~208 μm)的复合微球。该体系具有以下优势:一、通过摩擦触发脂质体持续暴露形成动态水合层(摩擦系数低至0.03),实现长效润滑(维持2个月);二、阳离子脂质体靶向递送雷帕霉素至软骨基质(靶向效率提升3倍),激活细胞自噬(LC3-II表达增加2倍);三、微流控技术确保微球单分散性和批次稳定性。该技术突破传统治疗局限,为骨关节炎等摩擦相关疾病提供了兼具创新性与治疗潜力的新策略。
参考文献:Injectable hydrogel microspheres with self-renewable hydration layers alleviate osteoarthritis
期刊(年份):Science Advances (2022)
来源:https://www.science.org/doi/full/10.1126/sciadv.abl6449
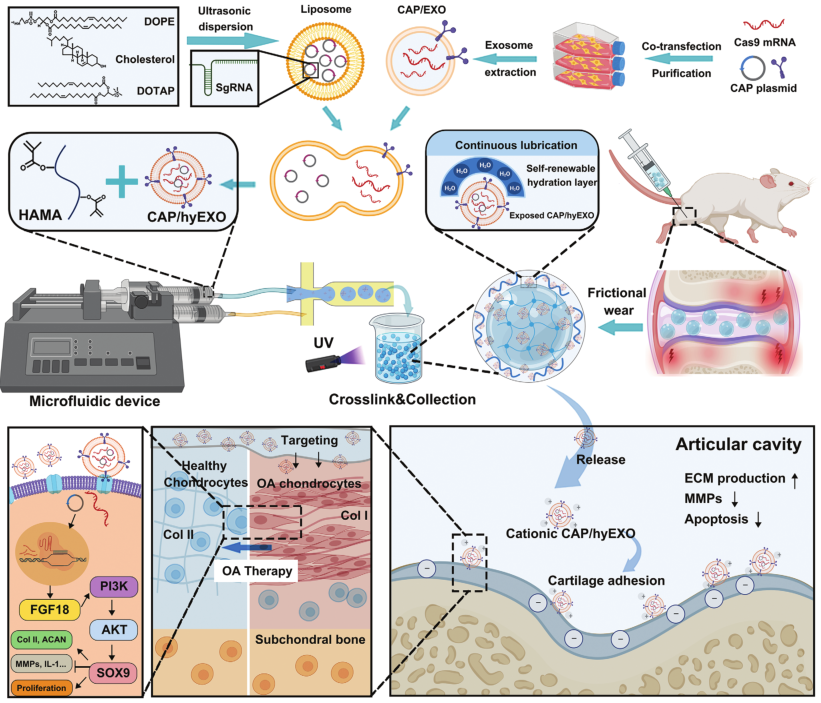
基于上述炎症问题,四川大学樊渝江教授团队提出了一种可注射基因编辑微凝胶系统(CAP/FGF18-hyEXO@HMs)。该体系首先通过膜融合技术构建混合外泌体(CAP/FGF18-hyEXO),将CRISPR/Cas9基因编辑工具(Cas9-sgFGF18)与软骨靶向肽(CAP)修饰的外泌体结合,再利用微流控技术将其封装于HAMA微凝胶中,形成粒径均一(~190 μm)的可注射微球。该体系具有以下优势:一、CAP修饰和阳离子特性实现软骨靶向递送(靶向效率提升3倍),激活FGF18基因表达(上调2.5倍),恢复软骨稳态;二、摩擦响应性释放机制形成动态水合层(摩擦系数降至0.25),实现长效润滑(维持25天);三、微流控技术确保载体的单分散性和批次稳定性。在ACLT大鼠模型中,该系统显著改善关节间隙(狭窄减少60%)、促进胶原II合成(增加2倍),并抑制炎症因子(IL-1β降低70%)。该技术突破传统单靶点治疗局限,通过基因编辑-材料工程的跨学科协同,为退行性关节疾病提供兼具生物学调控与物理润滑的“一针多效”治疗策略。
参考文献:Injectable microgels with hybrid exosomes of chondrocyte-targeted FGF18 gene-editing and self-renewable lubrication for osteoarthritis therapy
期刊(年份):Advances Materials (2024)
来源:https://advanced.onlinelibrary.wiley.com/doi/abs/10.1002/adma.202312559
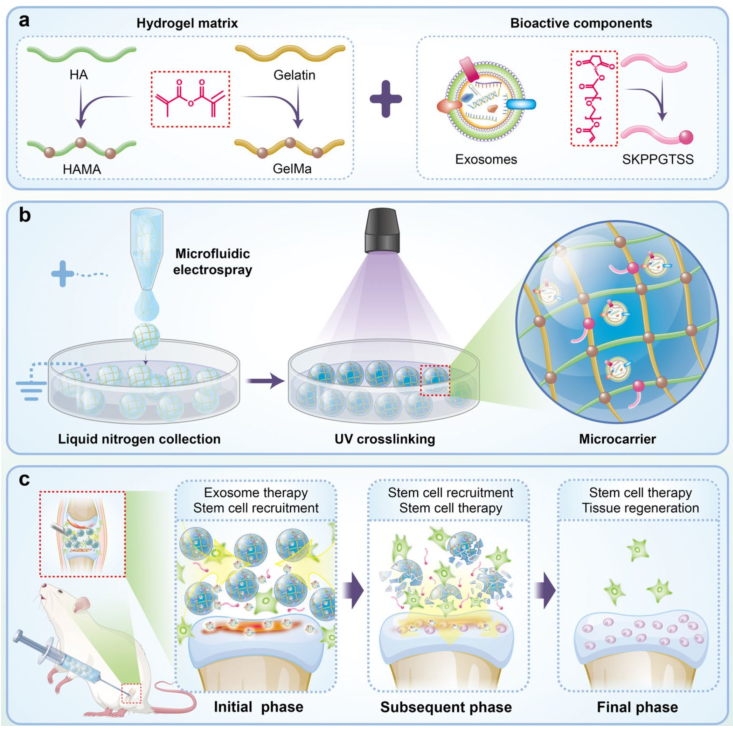
基于上述炎症问题,东南大学赵远锦教授团队又提出了一种基于微流控技术的多功能水凝胶微载体(Par@Pep&Exo)。该载体通过整合丙烯酰化干细胞募集肽(Pep) SKPPGTSS与人脐带间充质干细胞外泌体(Exo),利用微流控技术将其包封于HAMA与GelMA的水溶液中,并通过液态氮辅助快速固化形成均一多孔结构(~150 μm)。采用该技术制备水凝胶微载体时,一方面,可通过紫外共交联技术将丙烯酰化Pep SKPPGTSS固定于颗粒内,简化偶联步骤的同时延长Pep缓释时间,显著提升干细胞募集效率。另一方面,通过整合干细胞源Exo,实现多肽募集与外泌体修复功能的协同增效,体外及体内实验证实其可有效延缓OA进展并具备优异生物相容性。该系统突破传统单一治疗模式的局限,结合HAMA/GelMA的生物相容性优势,首次构建"募集-修复"双功能协同体系,为骨关节炎治疗提供兼具高效性和安全性的新型解决方案。
参考文献:Stem cell recruitment polypeptide hydrogel microcarriers with exosome delivery for osteoarthritis treatment
期刊(年份):Journal of Nanobiotechnology (2024)
来源:https://link.springer.com/article/10.1186/s12951-024-02765-1
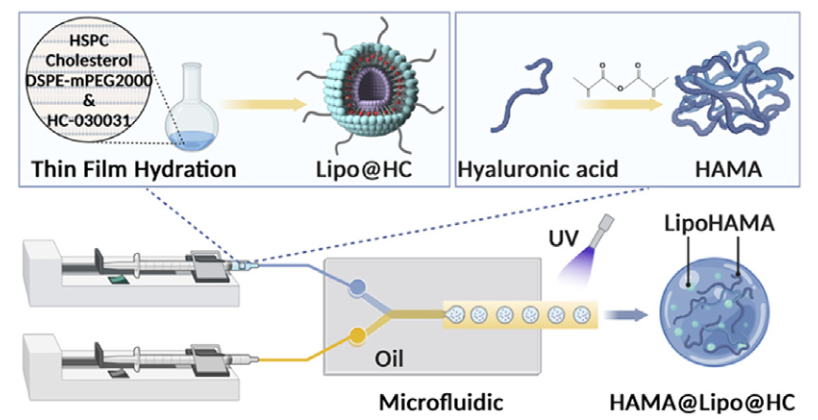
基于上述炎症问题,上海交通大学苏佳灿教授团队又提出了一种基于脂质体-水凝胶复合微球(HAMA@Lipo@HC)的新型靶向递送系统,用于OA的多机制协同治疗。该系统通过微流控技术将负载有TRPA1抑制剂HC-030031的脂质体(100-120 nm)封装于HAMA水凝胶微球内(粒径150 μm)。该复合递送系统,一方面通过脂质体(提升疏水药物溶解性)- HAMA水凝胶(作为缓释骨架)协同,实现双重调控药物释放。另一方面,采用靶向TRPA1治疗策略,首次将抑制剂用于OA治疗,从源头调控病理进程。该系统突破传统OA治疗的局限,结合HAMA的生物相容性优势,首次构建靶向TRPA1的"抗炎-修复-镇痛"多效协同递药体系,为骨关节炎治疗提供兼具精准性和长效性的新策略。
参考文献:Targeting TRPA1 with liposome-encapsulated drugs anchored to microspheres for effective osteoarthritis treatment
期刊(年份):Chinese Chemical Letters (2025)
来源:https://www.sciencedirect.com/science/article/abs/pii/S1001841724005722
3.代谢疾病与疼痛管理
3.1急性/慢性高尿酸血症伴肾损伤治疗
高尿酸血症(HUA)是一种由嘌呤代谢异常引发的慢性代谢紊乱,其发病率逐年升高且构成了严重的健康问题,并成为多种慢性病的主要危险因素。其病因由尿酸(UA)产生过多或排泄不足导致,因此治疗需减少UA产生与增强UA排泄。现有抗HUA药物(如嘌呤醇,苯溴马隆)有副作用,故临床亟待探索安全有效的HUA预防性治疗方法。
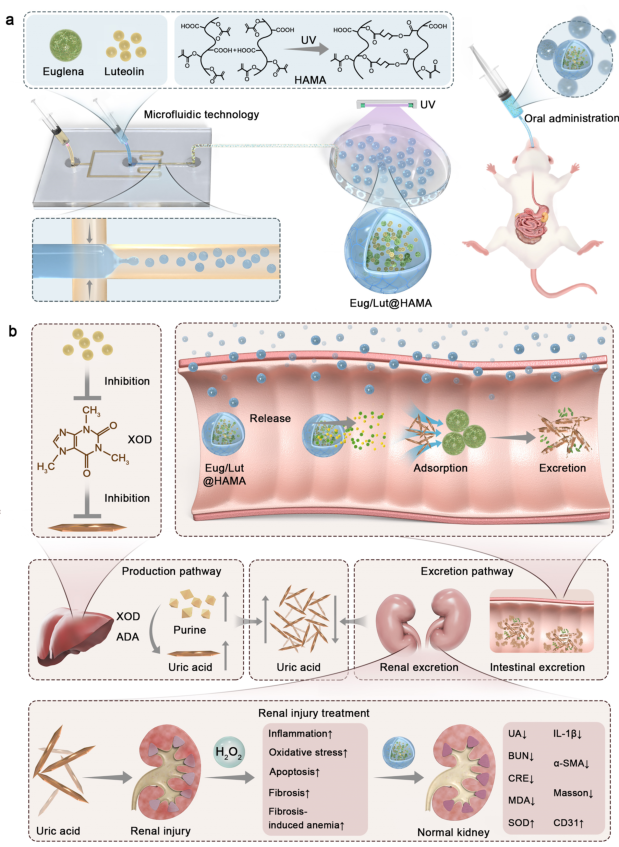
基于上述问题,浙江大学周敏教授团队首次提出了一种基于微藻的复合口服药物递送微球(Eug/Lut@HAMA)用于治疗HUA及其肾损伤。该体系通过微流控技术将眼虫藻(Euglena)和木犀草素(Luteolin)包载于HAMA中,形成粒径均一(~150μm)的口服微球。该体系具有以下优势:一、借助HAMA的pH响应特性实现肠道靶向缓释(滞留时间达8 h);二、Euglena通过β-葡聚糖高效吸附UA(吸附效率48%),Luteolin抑制黄嘌呤氧化酶活性(XOD抑制率与阳性药相当)减少UA生成;三、微流控技术确保载体的单分散性和高载药量(4 mg/mL)。在HUA小鼠模型中,口服给药显著降低血清尿酸水平(下降48%)、改善肾功能(肌酐和尿素氮降低40%)并减轻肾脏损伤(纤维化减少50%)。
该系统突破传统降尿酸药物的局限,结合天然成分的协同效应,首次构建"抑制生成-促进排泄"双机制治疗体系,为HUA及其肾损伤提供兼具高效性和安全性的口服治疗新策略。
参考文献:Microalgae-based drug delivery microspheres for treatment of hyperuricemia with renal injury
期刊(年份):Nano Today (2025)
来源:https://www.sciencedirect.com/science/article/abs/pii/S1748013224004638
3.2 糖尿病的治疗
糖尿病(DM)作为全球重大慢性疾病,2021年全球有5.37亿DM患者和840万1型糖尿病(T1DM)患者。对于T1DM的治疗,传统的胰岛素注射和新兴的胰岛移植虽能在不同程度上解决上述问题,但也存在一定弊端(如胰岛素注射影响生活质量、胰岛移植有免疫排斥风险)。近年来,多孔颗粒等生物相容性水凝胶通过封装β细胞实现免疫隔离,为细胞治疗开辟新途径。然而现有策略多聚焦单β细胞功能,忽视了α/β细胞相互作用机制及α细胞对血糖调控的协同作用。因此,亟需开发多细胞封装、设计结构优化的新型水凝胶以改善糖尿病治疗。
针对上述问题,东南大学李玲教授团队提出一种基于微流控纺丝技术的水凝胶微纤维封装胰腺α和β细胞新策略,用于治疗1型糖尿病。该策略将α细胞(α-TC)和β细胞(MIN-6)共同封装于海藻酸钠(Alg)与HAMA组成的双网络微纤维中,实现对血糖的双重调控:α细胞在低糖时释放胰高血糖素,β细胞在高糖时分泌胰岛素。采用该策略制备的水凝胶具有双网络结构实现细胞免疫隔离(存活率>90%)和长期功能维持(体外培养7 d仍保持活性)。在糖尿病小鼠模型中,将微纤维移植至棕色脂肪组织(BAT)可稳定血糖水平达6周,有效预防低血糖发生(发生率降低80%),并促进局部血管新生(CD31+血管密度增加2倍)。
该策略首创α/β细胞协同封装模拟天然胰岛功能,Alg-HAMA双网络兼具免疫隔离与仿生微环境特性,为糖尿病细胞治疗提供了安全长效的新策略。
参考文献:Pancreatic islet cells in microfluidic-spun hydrogel microfibers for the treatment of diabetes
期刊(年份):Acta Biomaterialia(2024)
来源:https://www.sciencedirect.com/science/article/pii/S1742706124004999
3.3 细胞外基质代谢平衡调节
细胞外基质(ECM)作为动态平衡的结构支持网络,其异常与多种疾病机制相关。微环境营养缺乏可致ECM代谢失衡,引发退行性疾病如软骨退化。调节ECM代谢平衡是治疗此类疾病的有效途径。当前,生长因子药物(如骨形态发生蛋白、胰岛素样生长因子-1)虽具调节作用,但多剂量需求、短半衰期及副作用限制其应用。与生长因子治疗不同,基因治疗(如长期表达治疗性蛋白、沉默病理基因)或从根本上调节ECM平衡,但面临核酸酶降解、转染效率低等挑战。因此,开发合适的基因载体对基因治疗药物递送至关重要。
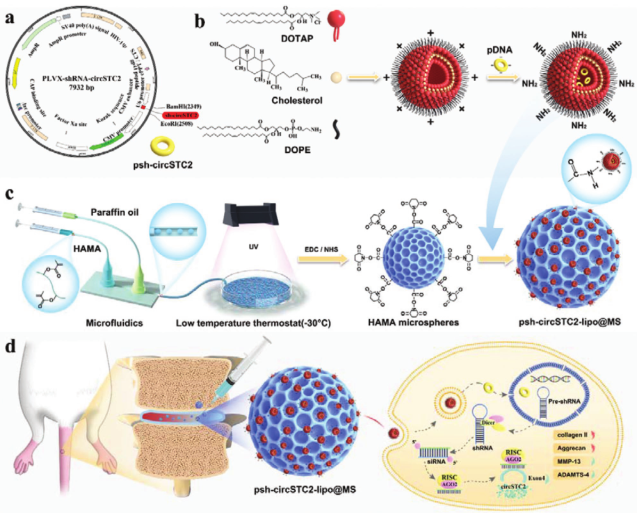
基于上述问题,同济大学刘晓东教授团队提出一种基于微流控技术的可注射基因沉默水凝胶微球(psh-circSTC2-lipo@MS),用于靶向调控椎间盘退变中的ECM代谢失衡。该系统利用微流控技术制备单分散性和尺寸可控的可注射HAMA微球,然后通过化学接枝将靶向circSTC2沉默基因的阳离子脂质体固定于HAMA微球表面。HAMA微球兼具可降解性、膨胀性和抗自由基损伤特性,脂质体通过共价键合实现circSTC2沉默基因的高效负载(封装效率95.6%)与缓释(持续27天)。
该系统首创circRNA沉默基因与脂质体-水凝胶微球复合递送体系,突破传统物理包埋的突释效应,通过微流控工程化构建仿ECM微环境,优化机械性能与药物释放动力学,最终实现靶向沉默circSTC2基因调控髓核细胞合成/分解代谢平衡。该研究为退行性疾病治疗提供了多学科融合的创新范式。
参考文献:Silencing Gene-Engineered Injectable Hydrogel Microsphere for Regulation of Extracellular Matrix Metabolism Balance
期刊(年份):Small Methods (2022)
来源:https://onlinelibrary.wiley.com/doi/abs/10.1002/smtd.202101201
综上所述,基于微流控技术的HAMA水凝胶在生物医学领域的应用已展现出显著优势与广阔前景。通过精准调控水凝胶的微观结构与理化特性,结合多功能生物活性分子的负载与智能响应性释放机制,HAMA水凝胶在组织修复、炎症调控及代谢疾病治疗中实现了突破性进展。其生物相容性、可降解性及低免疫原性为体内应用提供了安全保障,而微流控技术赋予的精准制造能力则进一步提升了递送系统的靶向性与效率。
尽管当前研究已取得阶段性成果,但HAMA水凝胶的临床转化仍面临挑战,如大规模制备工艺优化、长期体内安全性评估及复杂病理环境下的稳定性验证等。未来研究需进一步探索HAMA水凝胶与其他前沿技术(如基因编辑、人工智能)的交叉融合,推动其在个性化医疗与精准治疗中的应用。
本站文章内容旨在学习分享交流,部分素材来源于网络,如有侵权,请联系删除!































![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)



