
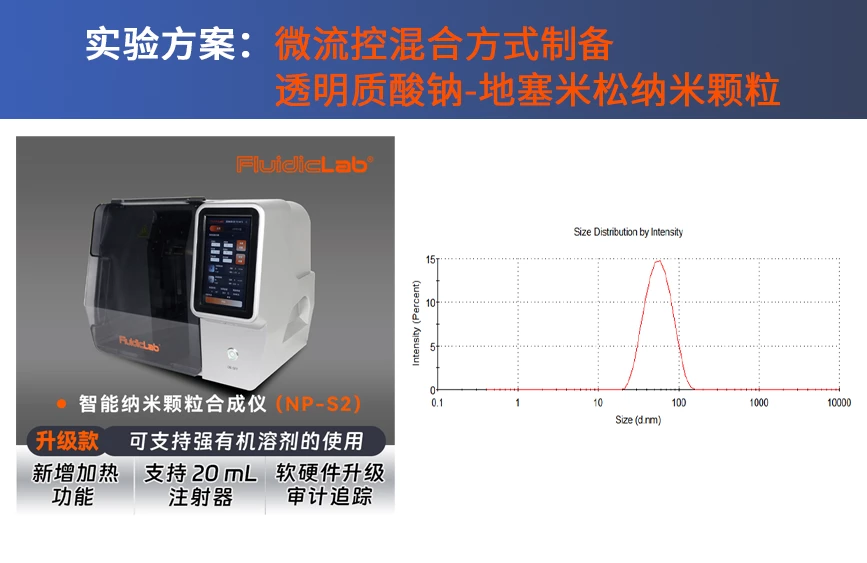
FluidicLab智能纳米颗粒合成仪(NP-S2)— 纳米药物合成系统
FluidicLab智能纳米颗粒合成仪(NP-S2)能够制备粒径高度均一且可控的纳米颗粒。经验证,NP-S2同时具备了高重复性、低样本消耗、易于操作等优势,大幅提高了客户前期配方筛选的效率。NP-S2也是一种纳米颗粒药物快速合成系统,可助力HYA-DEX纳米药物的合成。
目录
实验方案:微流控混合方式制备HYA-DEX纳米颗粒药物
1、配制地塞米松(DEX)溶液
2、配制透明质酸钠(HYA)溶液
3、微流控纳米药物合成(见智能纳米颗粒合成仪NP-S2操作说明)
4、粒径和PDI的检测
5、产物的处理和保存
附录
参考文献
| 温馨提示:由于实验方案在不断优化更新,以下实验方案内容仅供参考,如有需要,请通过网站上的联系方式向工作人员获取实时更新的版本PDF文件。(FluidicLab编辑并发布,转载请通知我们)。 |
实验方案:微流控混合方式制备透明质酸钠-地塞米松纳米颗粒药物
(HYA-DEX合成为例)
实验目的:
使用微流控方式,制备透明质酸钠-地塞米松纳米颗粒药物。
实验背景:
透明质酸钠(Sodium Hyaluronate)是透明质酸(Hyaluronic Acid,HYA)的钠盐形式,是一种葡聚糖醛酸,存在于各种组织的细胞外基质中,具有抗炎特性,在组织再生中起重要作用【1】。因为具有良好的支撑性和可扩展性【2,3】,所以可以有效地共封装不同的活性分子形成纳米颗粒【3】,实现高效药物递送。
地塞米松(dexamethasone,DEX)是一种糖皮质激素药物,广泛用于过敏性及自身免疫性疾病的治疗【4,5,6,7】,尤其是在肺部相关的疾病中有着重要作用【8,9,10】。但地塞米松经长期给药会带来肾功能衰竭等严重副作用【11】,使用透明质酸钠包裹地塞米松可以在降低给药量的同时提高递送效率【1】。在本文中,我们创新地利用微流控混合的方式合成透明质酸钠包裹地塞米松纳米颗粒药物,并建立了可靠的实验流程。
实验材料:
| 试剂 | 有机相成分(溶于无水乙醇) | DEX(地塞米松) |
| 缓冲液成分(溶于超纯水) | HYA(750-1000 kDa)(透明质酸钠) | |
| 溶剂 | 无水乙醇 | |
| 超纯水 | ||
| 耗材 | 合成需要 | BD/安德(新华)/KDL 带鲁尔口的注射器若干 |
| Falcon 15 mL离心管(352096) | ||
| 微混合芯片 | 微混合芯片 | FluidicLab LNP-B1 |
| 设备 | 微流控NP合成 | FluidicLab 智能纳米颗粒合成仪(型号:NP-S2) |
| NP检测 | 动态光散射仪(本文中使用的为 Malvern ZS90) |
实验步骤:
1、配制地塞米松(DEX)溶液:
配制浓度为5mg/mL的DEX乙醇溶液。
称取DEX 180 mg,加入36 mL乙醇。若溶解困难,可使用超声辅助溶解。使用0.22 μm 的PTFE滤膜过滤,确保终产物中不含微小的固态颗粒。
使用微流控合成HYA-DEX纳米药物时,HYA-DEX纳米颗粒药物粒径与DEX初始浓度相关联。经测试:当DEX浓度高于15mg/mL时不能完全溶解,DEX浓度低于5mg/mL浓度时,检测DLS数据count rate数值过低,数据不可信。当DEX浓度为5 mg/mL时可以获得该配方下粒径较小、最均一的HYA-DEX纳米颗粒药物;其浓度对其合成后的粒径影响可参考附录-附件1。
2、配制透明质酸钠(HYA)溶液:
配制浓度为1.379 mg/mL 的HYA水溶液。
称取HYA 20 mg,加入14.5 mL超纯水。若溶解困难,可使用超声辅助溶解。使用0.22 μm 的PTFE滤膜过滤,确保终产物中不含微小的固态颗粒。
使用微流控合成HYA-DEX纳米颗粒药物时,HYA-DEX纳米颗粒药物粒径与HYA初始浓度相关联。经测试当HYA浓度为1.379 mg/mL时可以获得该配方下粒径最小、最均一的HYA-DEX纳米颗粒药物;其浓度对其合成后的粒径影响可参考附录-附件2。
3、微流控纳米药物合成(见智能纳米颗粒合成仪NP-S2操作说明):

FluidicLab智能纳米颗粒合成仪(NP-S2)— 纳米药物合成系统
FluidicLab智能纳米颗粒合成仪(NP-S2)能够制备粒径高度均一且可控的纳米颗粒。经验证,S2同时具备了高重复性、低样本消耗、易于操作等优势,大幅提高了客户前期配方筛选的效率。 同时NP-S2也是一种纳米颗粒药物快速合成系统,可助力HYA-DEX纳米药物的合成。
当使用以上浓度微流控合成中的实验参数推荐如下:
1.对HYA水溶液40℃下预热3min;
2.合成前,提前将仪器设置为40℃,并预热;
3.微流控参数设定为:总流速10 mL/min、流速比1:3;
4.合成时、合成后对产物40℃下加热3min,可获得粒径小且均匀的HYA-DEX纳米颗粒药物。
实验者也可以根据实验需求对总流速、流速比、加热温度等参数进行调节优化来得到符合预期粒径的HYA纳米颗粒。关于微流控参数对HYA-DEX纳米颗粒药物合成的影响,及检测的稀释建议详见附录-附件3~5。
我们的测试发现,对于初始物料的加热会令实验的可重复性更好。而对于产物的加热可以帮助固化HYA-DEX纳米颗粒,更有利于其保存。不加热会形成多峰、杂峰。其影响详见附录-附件6~9。
4、粒径和PDI的检测:
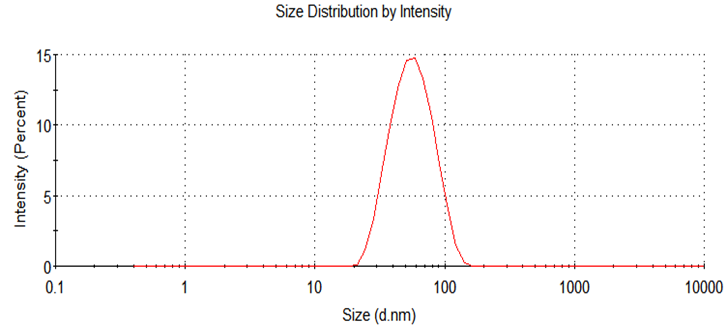
合成的纳米颗粒药物可使用动态光散射仪测定粒径与均一度。 正常结果如下图所示:
经测试,我们推荐的稀释方式是使用PBS缓冲液将合成产物(地塞米松+透明质酸钠总质量)稀释为1 mg/mL【1】进行DLS检测,设置粘度参数为2.5cP【1】,稀释溶液的确定过程参考附录-附件5,稀释浓度及粘度参数参考相关文献。
5、产物的处理和保存:
经测试,合成的HYA-DEX纳米颗粒药物可以在4℃下短时间内存放,粒径及PDI变化详见附录-附件10。切勿在-20℃和-80℃下冻存以及冷冻干燥,短时保存不需加入蔗糖作为冷冻保护剂。
附录
附件清单:
附件1:DEX溶液浓度与粒径/PDI的关系图;
附件2:HYA溶液浓度与粒径/PDI的关系图;
附件3:纳米颗粒药物合成总流速与粒径/PDI的关系图;
附件4:纳米颗粒药物合成流速比与粒径/PDI的关系图;
附件5:稀释溶液对纳米颗粒粒径/PDI的影响;
附件6:产物合成前预热不同相对粒径/PDI的影响;
附件7:产物合成前预热温度对粒径/PDI的影响;
附件8:产物合成前预热时间对粒径/PDI的影响;
附件9:产物加热时长对纳米颗粒药物粒径/PDI的影响;
附件10:产物4℃短时间保存对纳米颗粒药物粒径/PDI的影响;
附件1:DEX溶液浓度与粒径/PDI的关系图
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:不同浓度DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;超纯水稀释至10倍检测。
【结论】
该实验条件下,原浓度即5 mg/mL 的DEX乙醇溶液可得粒径和PDI最小的HYA-DEX纳米颗粒药物。
附件2:HYA溶液浓度与粒径/PDI的关系图
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;不同浓度的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;超纯水稀释至10倍检测。
【结论】
该实验条件下,原浓度即1.379 mg/mL 的HYA水溶液可得粒径最小的HYA-DEX纳米颗粒药物。虽然原浓度稀释2倍的HYA水溶液(0.5xHYA)粒径与未稀释时相差较小,但PDI显著增高,所以HYA水溶液浓度为1.379 mg/mL时合成纳米颗粒药物效果最好。
附件3:纳米颗粒药物合成总流速与粒径/PDI的关系图
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:流速比(脂相:水相=1:3);不同总流速;前废液0.3mL;使用超纯水稀释至10倍检测。
【结论】
该实验条件下,使用10mL/min的总流速即可获得粒径最小的HYA-DEX纳米颗粒药物。
附件4:纳米颗粒药物合成流速比与粒径/PDI的关系图
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;不同流速比;前废液0.3mL;使用超纯水稀释至10倍检测。
【结论】
该实验条件下,流速比1:4时粒径最小,但PDI显著增高,而流速比1:3时粒径与流速比1:4时相差较小,PDI较低,所以流速比1:3时时合成纳米颗粒药物效果更好。
附件5:稀释溶液对纳米颗粒药物粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;40℃对水相加热3min;使用不同稀释溶液将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,使用PBS缓冲液对产物稀释,获得的纳米颗粒药物粒径最小。
附件6:产物合成前预热不同相对粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;40℃对不同相加热3min;使用PBS将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,产物合成前对水相预加热,合成的纳米颗粒药物粒径最小。
附件7:产物合成前预热温度对粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;对水相不同温度加热;加热3min;使用PBS将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,产物合成前对水相40℃预加热,合成的HYA-DEX纳米颗粒药物粒径最小。
附件8:产物合成前预热时间对粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;对水相40℃加热;加热不同时长;使用PBS将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,产物合成前对水相40℃预加热3min,合成的HYA-DEX纳米颗粒药物粒径最小。
附件9:产物加热时长对纳米颗粒药物粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;合成前对水相40℃预热3min;产物40℃加热;加热不同时长;使用PBS将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,合成的HYA-DEX纳米颗粒药物在40℃下加热3min后粒径最小。
附件10:产物4℃短时间保存对纳米颗粒药物粒径/PDI的影响
实验条件:仪器:FludicLab-NP-S2;芯片:FludicLab-COC-LNP-B1
试剂浓度:5 mg/mL DEX乙醇溶液;1.379 mg/mL 的HYA水溶液
微流控参数:总流速:10 mL/min;流速比(脂相:水相=1:3);前废液0.3mL;合成前对水相40℃预热3min;产物40℃加热3min;使用PBS将产物稀释至1 mg/mL检测。
【结论】
该实验条件下,合成的HYA-DEX纳米颗粒可以在4℃下短时间保存48h,粒径及PDI无显著变化。
参考文献
- Candelaria Ines Camara, Laura Bertocchi et.al, Hyaluronic Acid—Dexamethasone Nanoparticles for Local Adjunct Therapy of Lung Inflammation;Candelaria Ines Camara, Laura Bertocchi et.al; Int J Mol Sci. 2021 Sep 28;22(19):10480.
- Martinelli F., Balducci A.G., Kumar A., Sonvico F., Forbes B., Bettini R., Buttini F. Engineered sodium hyaluronate respirable dry powders for pulmonary drug delivery. Int. J. Pharm. 2017;517:286–295.
- Rossi I., Buttini F., Sonvico F., Affaticati F., Martinelli F., Annunziato G., Machado D., Viveiros M., Pieroni M., Bettini R. Sodium Hyaluronate Nanocomposite Respirable Microparticles to Tackle Antibiotic Resistance with Potential Application in Treatment of Mycobacterial Pulmonary Infections. Pharmaceutics. 2019;11:203.
- Xu L., Xia H., Ni D., Hu Y., Liu J., Qin Y., Zhou Q., Yi Q., Xie Y. High-Dose Dexamethasone Manipulates the Tumor Microenvironment and Internal Metabolic Pathways in Anti-Tumor Progression.Int. J. Mol. Sci.2020;21:1846.
- Huang X., Duan Y., Zhao L., Liu S., Qin D., Zhang F., Lin D. Dexamethasone pharmacokinetics characteristics via sub-tenon microfluidic system in uveitis rabbits. J. Drug Deliv. Sci. Technol.2020;57:101639.
- Lohan S.B., Saeidpour S., Colombo M., Staufenbiel S., Unbehauen M., Wolde-Kidan A., Netz R.R., Bodmeier R., Haag R., Teutloff C., et al. Nanocrystals for Improved Drug Delivery of Dexamethasone in Skin Investigated by EPR Spectroscopy. Pharmaceutics. 2020;12:400.
- Salt A.N., Hartsock J.J., Hou J., Piu F. Comparison of the Pharmacokinetic Properties of Triamcinolone and Dexamethasone for Local Therapy of the Inner Ear. Front.Cell. Neurosci. 2019;13:347.
- Hynes D., Harvey B.J. Dexamethasone Reduces Airway Epithelial Cl− Secretion by Rapid Non-Genomic Inhibition of KCNQ1, KCNN4 and KATP K+ Channels. Steroids. 2019;151:108459.
- Mushkat Y., Ascher-Landsberg J., Keidar R., Carmon E., Pauzner D., David M.P. The effect of betamethasone versus dexamethasone on fetal biophysical parameters. Eur. J. Obstet. Gynecol. Reprod. Biol.2001;97:50–52.
- Villar J., Ferrando C., Martínez D., Ambrós A., Muñoz T., Soler J.A., Aguilar G., Alba F., González-Higueras E., Conesa L.A., et al. Dexamethasone treatment for the acute respiratory distress syndrome: A multicentre, randomised controlled trial. Lancet Respir. Med. 2020;8:267–276.
- Lee H., Jeong S.W., Jung E., Lee D. Dexamethasone-loaded H2O2-activatable anti-inflammatory nanoparticles for on-demand therapy of inflammatory respiratory diseases. Nanomed. Nanotechnol. Biol. Med. 2020;30:102301.






































![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)



