1.前言
聚乙烯醇(PVA)作为一种人工合成高分子聚合物,具有无毒、优异生物相容性及富含可修饰羟基的特性,在生物医学领域应用广泛。其中,PVA微球因其高亲水性、可调控机械强度与生物降解性,成为栓塞治疗、细胞微封装及药物控释载体的理想材料。然而,传统方法(如乳化萃取、喷雾干燥)制备的PVA微球存在尺寸多分散性高(尺寸不均一)、球形度差等技术瓶颈,进而引发微球体系在临床转化过程中面临批次间差异大、栓塞定位不精准及药物释放不可控等问题,严重制约了其临床应用。而液滴微流控技术通过精准操控流体,可制备单分散和球形度俱佳的PVA微球,从而有效解决上述问题。本文综述近年来基于微流控的PVA水凝胶微球制备方法及其生物医学应用进展,重点探讨技术优化对材料性能及临床应用的促进作用。
2.基于微流控技术的PVA水凝胶微球制备
基于微流控技术的PVA水凝胶微球制备是以精确操控流体为核心,以PVA基水溶液(可负载功能组分)为分散相,含表面活性剂的油相为连续相,通过微流控芯片生成单分散液滴。液滴经可控交联固化为PVA微球,其固化机制一般分为三类:化学交联、光聚合和物理交联。
2.1化学交联法
化学交联法一般是通过化学交联剂与PVA分子链的羟基(-OH)反应,形成共价键网络结构,以实现液滴向固态微球的转化。在PVA水凝胶微球制备中,通常是以戊二醛(GA)为交联剂,在酸(例如盐酸、乙酸和乙酸酐)催化条件下结合加热处理,促进GA的醛基(-CHO)与PVA的羟基(-OH)发生缩醛反应,形成共价化学键(图1A)。例如,Luo等开发了一种基于微流控技术的原位酸催化交联法用于制备大小可控、形状规则的PVA水凝胶微球[1]。该技术采用毛细管基T型结构芯片,以PVA/GA水溶液为分散相,含乙酸酐的硅油/四氯化碳混合液为连续相,通过调控两相流速制备粒径均一液滴;在液滴收集过程中,油相内乙酸酐自发水解,产生的乙酸扩散至分散相中催化PVA与GA交联固化制备微球(图1B)。
图1. 基于微流控的PVA/GA-乙酸酐固化制备PVA微球[1]
类似的,Wang等[2]设计了一种集成化PDMS微流控芯片(集成液滴生成、混合与预固化功能于一体)用于制备PVA微球(图2)。该方法通过集成化微流控芯片同步实现:双水相(PVA水溶液,GA-盐酸溶液)在流动聚焦结构中被连续相剪切形成单分散液滴,液滴在芯片通道内高效混合,再经预固化及浓度固化获得微球。
图2. 基于微流控的PVA/GA-盐酸固化制备PVA微球(双水相)[2]
不同于上述化学交联法,Yang等[3]开发出一种硼酸碱性触发交联固化方法。该方法基于毛细管微流控装置,通过调控装置尺寸和两相流速比生成单分散PVA/硼酸液滴,液滴在含有NaOH溶液中触发硼酸水解为B(OH)₄⁻,与PVA羟基共价交联固化(图3)。
图3. 基于微流控的PVA/硼酸-NaOH固化制备PVA微球[3]
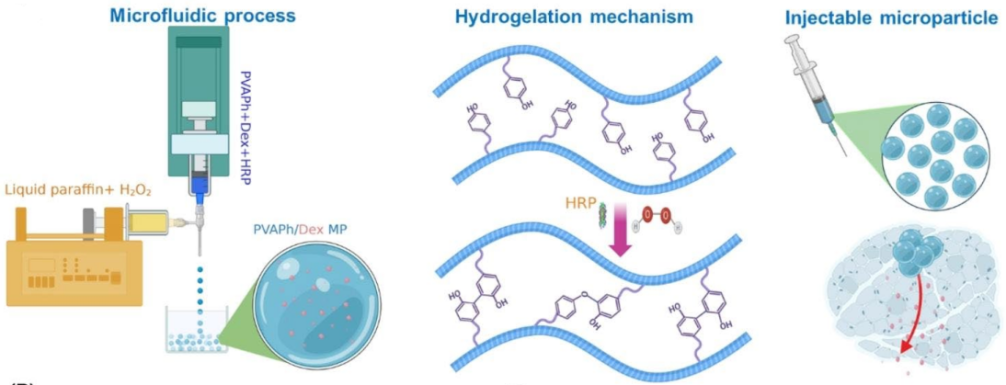
此外,也有文献报道[4]采用酶促交联制备PVA基微球(图4)。该技术基于同轴微流控装置,通过调控分散相(含苯酚修饰基团修饰PVAPh、辣根过氧化物酶(HRP)和药物Dex)与流动相(含H2O2的液体石蜡)流速生成单分散液滴,液滴在连续相中触发HRP酶催化H2O2氧化酚基(Ph),引发酚基共价交联固化获得载药微球。
图4. 基于微流控的PVAPh/HRP-H2O2固化制备PVA基微球
2.2物理交联法
针对传统PVA微球制备中交联剂或催化剂残留问题,Han等[5]提出基于微流控技术的物理交联固化制备PVA微球。该技术利用Y型微流控芯片生成单分散PVA液滴,所得液滴在收集腔室内经三次冻融循环触发PVA分子物理交联,形成微晶结构固化微球(如图5)。
2.3光聚合法
针对传统细胞微囊技术制备的微球多分散性及缺乏细胞识别位点等问题,Young等开发了一种基于微流控技术和紫外光聚合的方法,制备单分散性PVA-肝素(PVA-heparin)生物合成微球[6]。该技术通过同轴毛细管微流控装置将甲基丙烯酸酯化PVA (PVA-MA)与甲基丙烯酸缩水甘油酯化肝素(heparin-MA)混合液制备成液滴,并通过紫外照射触发甲基丙烯酸酯基团共价交联固化,获得PVA-heparin微球。
图6. 基于微流控的PVA-heparin微球制备[6]
3.基于微流控技术的PVA微球应用
3.1栓塞治疗
具有球形结构和尺寸均一的栓塞微球易于分散流动并能保护负载药物,在肿瘤和血管病变的栓塞治疗中至关重要,可提高疗效并减少副作用。然而,栓塞微球的大小均匀性极大地影响栓塞性能。因此,实现其尺寸和弹性的精确控制是提升治疗效果的关键。Yang等开发了一种基于液滴微流控技术和硼酸碱性交联策略的连续化制备方法,用于可控制备尺寸均一、力学性能可调的PVA栓塞微球[7]。体外栓塞芯片实验证实,微球在20 mbar压力下能完全阻塞170–800 μm仿生血管,流量从7.25 μL/s降至零。该技术为栓塞治疗提供了尺寸与力学性能可定制、载药功能一体化的高性能PVA微球。
针对上述球形栓塞材料,有报道称球形微粒易反流导致非靶向栓塞。为此,Luo等开发了一种基于T型结-蛇形通道结构和戊二醛交联的制备方法,可连续合成形状各向异性的PVA微栓塞剂用于经动脉栓塞治疗[8]。通过调控表面活性剂浓度和两相流速比,精准控制微粒几何形态,形成胶囊状结构。在体内兔耳动脉栓塞实验中进一步验证其14天栓塞稳定性及生物相容性。
图7. 基于微流控的形状各向异性的PVA微球制备[8]
3.2药物递送系统
PVA因其优异的亲水性、可降解性、组织黏附性、可调机械性能和高生物相容性,成为构建药物递送载体的理想材料。其三维网络结构通常需通过化学交联实现,而辣根过氧化物酶(HRP)介导的快速凝胶化特性尤其适用于微流控技术精准制备微粒。基于此,Majareh研究团队开发的一种基于同轴微流控技术和酶促交联的连续化制备系统,成功合成尺寸均一的苯酚改性聚乙烯醇(PVAPh)载药微球,用于地塞米松(Dex)的局部缓释递送[4]。该技术通过HRP/H2O2催化苯酚基团交联,实现单分散PVAPh微球的高效封装和机械稳定性。研究表明,负载Dex的PVAPh微球维持长达7天的缓释,且对小鼠成纤维细胞无毒性,细胞线粒体活性在4天内提升3倍。
3.3细胞包裹
基于微流控的亲水性水凝胶包裹细胞在组织工程、细胞移植治疗和单细胞分析中至关重要。然而,天然聚合物(如海藻酸钠)条件温和但难以调控性能(如孔隙率、弹性、功能基团),影响细胞行为(如迁移、粘附、信号传导),影响细胞行为。Aikawa等开发了一种基于微流控技术和仿生聚合物自组装的制备方法,可连续合成单分散性PMBV/PVA水凝胶微不过用于活细胞包裹(图8)[9]。该技术实现含苯硼酸基团的仿生磷脂聚合物PMBV与PVA在微流控装置中混合生成液滴,并通过硼酸-二醇特异性络合自发交联固化成微球。在体外HL-60细胞包裹实验中验证其单细胞包裹能力(40 μm微球封装率达31%)及细胞活性(细胞存活率超过96%)。
图8. 基于微流控的PMBV/PVA微球制备[9]
类似的,Hou等人[10]则成功开发了一种基于微流控技术和点击化学交联的制备方法,可高效合成可注射降解型PVA微球用于骨髓间充质干细胞(hMSCs)成骨分化调控(图9)。该技术通过微流控装置将聚乙烯基醚丙烯酸酯功能化PVA (PVA-VEA)与硫醇化PVA (PVA-VEA-SH)混合形成液滴,并利用迈克尔加成反应在温和条件下自发交联固化。在hMSCs/BMP-2共封装实验中验证其细胞高活性(7天存活率>80%)、可控增殖及成骨定向分化能力。
图9. PVA-VEA-SH水凝胶微球的制备[10]
4.总结
聚乙烯醇(PVA)微球凭借其优异的生物相容性、可修饰性及可控降解性,在生物医学领域展现出广阔前景。然而,传统制备方法(如乳化法、喷雾干燥)因尺寸多分散性高、球形度差等问题,导致微球批次稳定性不足、药物释放不可控及栓塞定位精度低,严重限制了临床转化。微流控技术则将进一步与智能材料设计、多功能集成芯片结合,推动PVA微球在个性化栓塞剂、靶向递药系统及再生医学中的临床应用,最终实现“制备-性能-应用”一体化精准调控。
参考文献
- Luo. D, et al. Novel synthesis of PVA/GA hydrogel microspheres based on microfluidic technology. J Flow Chem, 2020, 10, 551-562.
- Wang J, et al. Microfluidic rapid fabrication of tunable polyvinyl alcohol microspheres for adsorption applications. Materials, 2019, 12, 3712.
- Yang. S. H, et al. Controllable fabrication of monodisperse poly (vinyl alcohol) microspheres with droplet microfluidics for embolization. Ind Eng Chem Res, 2022, 61(34), 12619-12631.
- Abdi Majareh M, et al. Sustain release of dexamethasone from polyvinyl alcohol microparticle produced via coaxial microfluidic system. Bmc Res Notes, 2023, 16(1), 268.
- Han. X. W, et al. Preparation of poly (vinyl alcohol) microspheres based on droplet microfluidic technology. Chinese J Anal Chem, 2018, 46, 1269-1274.
- Young. C, et al. Poly (vinyl alcohol)-heparin biosynthetic microspheres produced by microfluidics and ultraviolet photopolymerisation. Biomicrofluidics, 2013, 7(4).
- Yang. S. H, et al. Controllable fabrication of monodisperse poly (vinyl alcohol) microspheres with droplet microfluidics for embolization. Ind Eng Chem Res, 2022, 61(34), 12619-12631.
- Luo. Y, et al. Shape‐Anisotropic Microembolics Generated by Microfluidic Synthesis for Transarterial Embolization Treatment. Adv Healthc Mater, 2022, 11(10), 2102281.
- Aikawa T, et al. Spherical phospholipid polymer hydrogels for cell encapsulation prepared with a flow-focusing microfluidic channel device. Langmuir, 2012, 28(4), 2145-2150.
- Hou. Y, et al. Injectable degradable PVA microgels prepared by microfluidic technology for controlled osteogenic differentiation of mesenchymal stem cells. Acta Biomater, 2018, 77, 28-37.




![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图 图1. 基于微流控的PVA/GA-乙酸酐固化制备PVA微球[1]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-1-e1754556603342.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图1 图2. 基于微流控的PVA/GA-盐酸固化制备PVA微球(双水相)[2]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-2.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图2 图3. 基于微流控的PVA/硼酸-NaOH固化制备PVA微球[3]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-3.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图4 图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图5 图6. 基于微流控的PVA-heparin微球制备[6]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-6.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图6 图7. 基于微流控的形状各向异性的PVA微球制备[8]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-7.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图7 图8. 基于微流控的PMBV/PVA微球制备[9]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-8-e1754556835908.png)
![基于微流控技术的聚乙烯醇(PVA)微球制备及其应用插图8 图9. PVA-VEA-SH水凝胶微球的制备[10]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-9.png)