1.前言
液滴微流控技术因高通量、低样本消耗及精准操控能力,成为分子生物学实验核心工具,在数字聚合酶链式反应(ddPCR)和单细胞分析等领域优势显著。其中,表面活性剂性能决定液滴体系稳定性,影响实验结果准确性与可重复性。
热稳定性是评价表面活性剂在分子生物学实验适用性的关键指标。反转录与 ddPCR 等关键步骤涉及中高温反应,对表面活性剂耐热性要求严苛。反转录需在40-50 ℃维持酶活性,然后通过高温使酶失活;ddPCR 经历多次高低温循环,液滴界面易受温度波动影响,热稳定性不足会导致液滴融合等问题,干扰实验。
Drop-Surf®全氟表面活性剂(货号:DGO-N-001)作为一款在分子生物学实验中应用广泛的商用氟基表面活性剂,其热稳定性直接关系到液滴体系的稳定性及实验结果的可靠性。为客观、全面验证其核心性能优势,本文选取法国某品牌(以下简称为F品牌)、美国某品牌(以下简称为A品牌) 两款国际主流氟基表面活性剂作为对照,通过反转录和ddPCR两个分子生物学关键实验场景,聚焦热稳定性核心指标开展系统对比测试,为实验人员的科学选型提供数据支撑与实践参考。
2.测试结果
2.1 Drop-Surf®全氟表面活性剂在ddPCR中的热稳定性测试
图1、 ddPCR前(A)后(B)液滴稳定性对比图
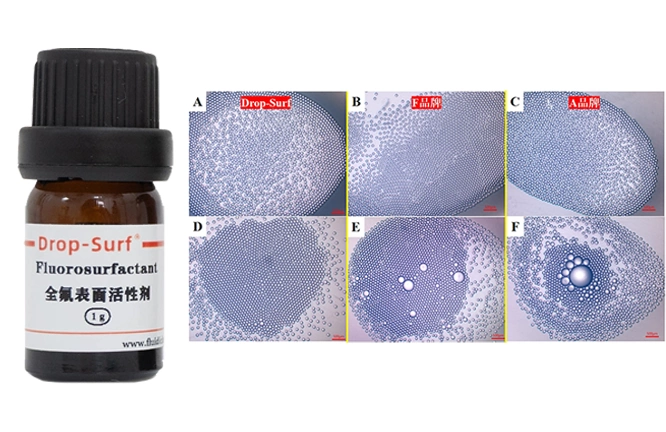
如图1所示,经ddPCR处理后,三款商用表面活性剂形成的液滴热稳定性表现出显著差异。其中,A品牌表面活性剂对应的液滴发生严重融合;F品牌表面活性剂对应的液滴的热稳定性略优于A品牌,融合程度相对较低;Drop-Surf®表面活性剂对应的液滴则具有相对突出的热稳定性,在观察中几乎未发现明显融合迹象。这一结果在图2的显微镜图像中得到了更为深入的验证与证实。
图2 、 ddPCR前(A-C)后(D-F)液滴形态的显微镜对比图
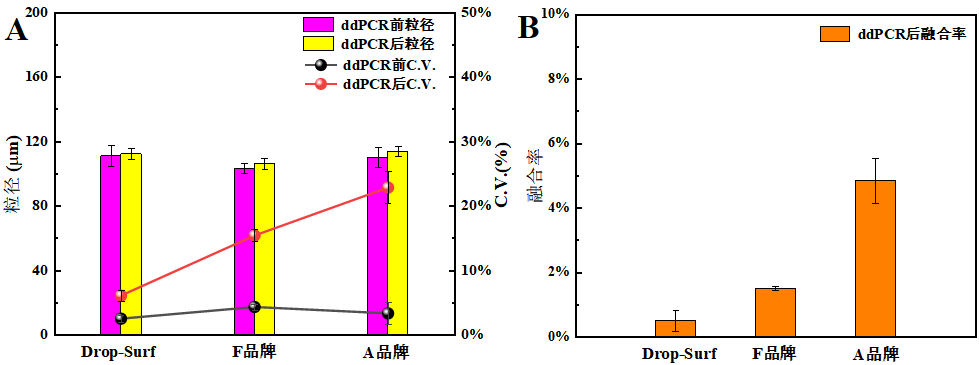
由图3A可知,经ddPCR处理后,三款表面活性剂形成的液滴平均粒径变化不大。但在单分散性(用变异系数C.V.衡量)上差异明显。A品牌和F品牌表面活性剂对应的液滴变异系数依次是22.83%、15.41%,二者在ddPCR处理后单分散性均显著降低。而Drop-Surf®表面活性剂对应的液滴变异系数仅有6.09%,展现出相对优异的单分散性。这一结果和前面得出的结论一致。
图3 、ddPCR前后液滴单分散性变化(A)及ddPCR后融合率统计(B)
图3B呈现了ddPCR处理后液滴融合率的统计数据。由对比分析可知,A品牌和F品牌表面活性剂对应的液滴融合率依次为4.84%,1.51%。 而Drop - Surf®表面活性剂对应的液滴融合率仅为0.51%,显著低于前两者。这一量化结果进一步从融合率的角度有力地表明,Drop - Surf表面活性剂在ddPCR处理过程中具备优异的热稳定性,为相关研究提供了坚实的数据支撑。
2.2 Drop-Surf®全氟表面活性剂在反转录中的热稳定性测试
图4 、反转录前(A)后(B)液滴稳定性对比图
由图4所示,经反转录处理后,三款商用表面活性剂所形成的液滴在热稳定性方面未表现出显著差异,均未观察到明显的融合现象。这一结论同样在图5的显微镜对比图中得到了进一步的有力佐证。
图5 、反转录前(A-C)后(D-F)液滴形态的显微镜对比图
图6A量化了反转录前后三款表面活性剂所制备的液滴平均粒径及单分散性,其结果进一步佐证了上述结论。
图6、 反转录前后液滴单分散性变化(A)及反转录后融合率统计(B)
图6B呈现了反转录处理后液滴融合率的统计数据。A品牌、F品牌和Drop - Surf这三款表面活性剂对应的液滴融合率分别为0.58%,0.32%和0.01%。这进一步从量化角度有力地表明,在反转录过程中,这三款表面活性剂制备的液滴热稳定性差异在统计学上并不显著。
3.材料与方法
3.1实验材料
设备:FluidicLab 压力控制器及配套流量传感器,PCR仪(伯乐),普通光学显微镜。
表面活性剂: Drop-Surf® (DGO-N-001), F品牌(法国某品牌), A品牌(美国某品牌)
基底油:3M Novec™ 7500 (HFE-7500)
表1. dd PCR试剂
| 初始浓度 | 体积(µL) | 终浓度 | |
| Tris-HCl(pH=8.0) | 1000 mM | 50 | 10 mM |
| KCl | 1000 mM | 250 | 50 mM |
| MgCl2 | 300 mM | 25 | 1.5 mM |
| Tween-20 | 10% | 50 | 0.10% |
| dd H2O | - | 4625 | - |
| 总体积 | - | 5000 | - |
表2. 反转录试剂
| 初始浓度 | 体积(µL) | 终浓度 | |
| Tris-HCl(pH=8.0) | 1000 mM | 250 | 50 mM |
| KCl | 1000 mM | 375 | 75 mM |
| MgCl2 | 300 mM | 50 | 3 mM |
| 甘油 | 50% | 500 | 5% |
| DTT | 1000 mM | 50 | 10 mM |
| Triton X-100 | 10% | 50 | 0.10% |
| Tween-20 | 10% | 400 | 0.80% |
| dd H2O | - | 3305 | - |
| 总体积 | - | 5000 | - |
3.2 ddPCR测试
表3. 微滴生成条件
| 微流控芯片 | PDMS-FF-100 |
| 油相试剂 | 2% w/w表面活性剂(溶解于HFE-7500) |
| 水相试剂 | PCR试剂 |
| 油相流速 | 30 µL/min |
| 水相流速 | 20 µL/min |
表4. ddPCR运行程序
| 温度 | 时间 | 循环数 | |
| 1 | 95℃ | 3 min | 1 |
| 2 | 98℃ | 20 s |
40 |
| 3 | 65℃ | 20 s | |
| 4 | 72℃ | 30 s | |
| 5 | 72℃ | 3 min | 1 |
| 6 | 4℃ | 10 min | 1 |
稳定性评估:取50 µL 油水乳液放置于PCR管按相应程序进行dd PCR测试
3.3 反转录测试
表5. 微滴生成条件
| 微流控芯片 | PDMS-FF-100 |
| 油相试剂 | 2% w/w表面活性剂(溶解于HFE-7500) |
| 水相试剂 | 反转录试剂 |
| 油相流速 | 30 µL/min |
| 水相流速 | 20 µL/min |
表6. 反转录运行程序
| 温度 | 时间 | 循环数 | |
| 1 | 42℃ | 90 min | 1 |
| 2 | 50℃ | 2 min | 11 |
| 3 | 42℃ | 2 min | |
| 4 | 85℃ | 5 min | 1 |
| 5 | 4℃ | 10 min | 1 |
稳定性评估:取50 µL 油水乳液放置于PCR管按相应程序进行反转录测试
3.4 实验设计原则
单一变量控制:三款表面活性剂添加浓度一致,其他反应条件统一;
平等实验设置:每组实验设3次重复实验,降低随机误差;
评价指标:反应前后液滴平均粒径变化(µm)、液滴平均粒径变异系数(反映热稳定性导致的液滴融合)、温度循环后液滴融合率(融合液滴数/总液滴数×100%)
注:本研究仅反映实验室环境下的性能表现,实际使用效果可能因实验条件不同而存在差异。







































![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)



