一、背景
维生素C又名抗坏血酸,是一种水溶性的维生素。其中L-抗坏血酸被认为是四种异构中具有最高生物活性的。维生素C具有强还原性,具有抗氧化、抗炎、抗凝血和免疫调节特性。维生素 C 在胶原蛋白合成和坏血病预防中起着重要作用[1]。
脂质体包裹传统方式包括薄膜水合法、旋转蒸发法、膜挤出法等,常搭配超声进一步降低粒径和多分散性指数(PDI)。然而这些方法产出的脂质体,具有粒径大而不均一的问题,同时药物使用率低、包封率低。FluidicLab(上海澎赞生物科技有限公司)近期利用微流控设备(NP-S2)及芯片(LNP-C2芯片)成功制备了维生素C-脂质体(Vc-Liposome)。使用微流控的方法进行脂质体的制备,高度可控,高度可重复。近期受到了越来越多的关注。
然而我们发现,针对脂质体包裹的维生素C使用率、包封率的检测成为了一大难题。常规的维生素C检测有以下几种方式:1)高效液相色谱,或色谱-质谱联用检测;2)2,6-二氯靛酚滴定法;3)基于啡罗啉显色反应的分光光度法;4)直接紫外分光光度检测;5)固蓝B盐紫外分光光度法。维生素C-脂质体作为检测样本,方案1~4均有较为明显的缺陷,详细原因见附录-附件。最后通过查阅文献[2],我们最终采取了固蓝B盐紫外分光光度法对维生素C包封率进行了检测,并对其进行了优化。
| 温馨提示:由于实验方案在不断优化更新,以下实验方案内容仅供参考,如有需要,请通过网站上的联系方式向工作人员获取实时更新的版本PDF文件。(FluidicLab编辑并发布,转载请通知我们)。 |
二、试剂材料准备
#1:Na2EDTA具有比EDTA更好的中和能力
#2:固蓝B盐检测法检测波长为420nm,石英比色皿可用于190-900nm全波段检测,玻璃比色皿仅用于可见光波段。420nm接近紫外区,建议使用石英比色皿以提高检测精度。
三、试剂配置
1.固蓝B盐溶液的配置
终浓度为:2g / L,
称取0.5g,溶于250 mL ddH2O中。避光,现配现用。
# 注意固蓝B盐危险代码为R45: 可能致癌;R61: 可能对未出生的婴儿造成伤害;R20/21/22: 吸入、皮肤接触和吞食有害。使用和配置过程中请穿好实验服,佩戴手套、口罩、防护镜,确保使用安全。
2.进行预混液反应液【Mixture】的配置:
【Mixture】=
| + 225 μL 【Na2EDTA (0.2 M)】+ 300 μL 【CH3COOH (0.5 M)】 + 750 μL 【固蓝B盐溶液(2 g /L)】+ 225 μL 【1×PBS】补足 |
【Mixture】准备数量:
破乳前后各要进行一次标曲的制备,准备:
| (6 × 2 + 样品数 ) + 2 个冗余反应的【Mixture】 |
3.打开紫外分光光度计进行预热,一般至少预热10min。
四、标曲制备
1.空包脂质体+Vc的标曲制备。 #用于破乳前Vc含量的测定
| 500 μL【空包脂质体】+ 500 μL 【Vc标准品】+ 【1×PBS】 定容至1.5 mL; |
【Vc标准品】的配置,可配置2.5份:
| + 0 / 10 / 20 / 50 / 100 / 200μL 【1mg/mL】PBS-Vc+500/490/480/450/400/300μL 【1×PBS】 |
## 请使用合适的移液枪精确吸取
## 该体系等效于0.5 mL样品中,Vc含量为0;20;40;100;200;400μg/mL Vc;
## 脂质体本身于420nm波长处有一定的吸收,故在做标曲的时候,破乳前后500μL的脂质体添加是必要的(见附录-图4.);
## 一般标曲作6个标准点能做到较高的准确性。根据紫外分光光度计的检测灵敏度和检测极限,可进行适当调整。一般确保最高吸光度低于1.5较为可信。
2.空包脂质体+Vc+破乳的标曲制备 #用于破乳后Vc含量的测定
| 500 μL【空包脂质体】+ 500 μL 【Vc标准品】+ 375μL【8% Triton X-100】+125μL【1×PBS】 |
静置3min确保破乳充分。
3.随后将制备好的1.5 mL标曲加入1.5 mL【Mixture】,合并为3 mL,静置30min后进行检测。
五、检测
| 1.破乳前待测产物= 500μL【待测原液产物】+ 1000 μL【1×PBS】稀释 或 2.破乳后待测产物= 500μL【待测原液产物】+ 375 μL【8% Triton X-100】 + 625 μL【1×PBS】 |
##破乳需要额外加入破乳剂。为了测量体系的一致,非破乳标曲也需要加入PBS来统一体积。维生素C-脂质体一般需要浓缩,也可根据浓度情况,对产物再做稀释后,取500μL。
3.加入1.5 mL 【Mixture】,组成3 mL的反应测量液体;
4.在配置完成后静置30min;
5.设置波长:420nm;
6.加入3 mL ddH2O石英比色皿进行调零;
7.进行破乳前标曲的测量(图1.A 右侧);
8.对破乳前样品进行检测;
9.进行破乳后标曲的检测(图1.B 右侧);
10.对破乳后样品进行检测;
| A. |  | 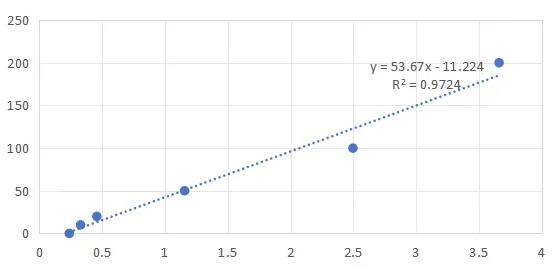 |
| B. |  | 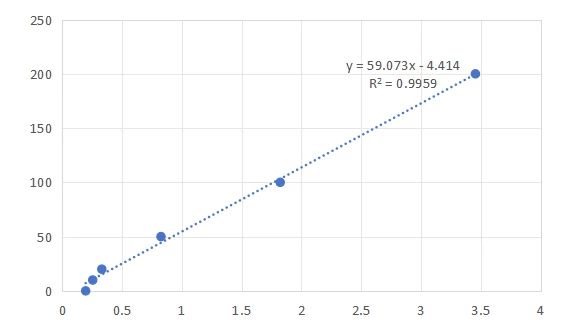 |
| 图1. A 破乳前的标曲制备及标曲示意图。 B.破乳后的标曲制备及标曲示意图。 | ||
如图1. A-B所示破乳前后,相同浓度的维生素C也存在差异。故两个标曲是必要的。
11.根据各自的标曲算出维生素C的浓度,并得到包封率和利用率。
1)进行包封率的计算,公式为:
2)同时可进行RNA利用率的计算,公式为:
参考文献
(1)Grădinaru, A. C.; Popa, S. Vitamin C: From Self-Sufficiency to Dietary Dependence in the Framework of Its Biological Functions and Medical Implications. Life Basel Switz. 2025, 15 (2), 238. https://doi.org/10.3390/life15020238.
(2)Wang, R.; Ma, C.; Yan, H.; Zhao, H.; Wang, P.; Zhang, S.; Ju, J.; Yu, S.; Yin, Z. Lecithin/Cholesterol/Tween 80 Liposomes for Co-Encapsulation of Vitamin C and Xanthoxylin. ACS Appl. Nano Mater. 2024, 7 (6), 5982–5995. https://doi.org/10.1021/acsanm.3c05884.
附录
1)高效液相色谱,或色谱-质谱联用检测;
无论是HPLC或者LC-MS,首先需要有昂贵的检测设备以及耗材。需要超高纯度的试剂来降低污染且操作流程复杂,导致了使用的高门槛。配方优化中,需要每一种测试条件够以低成本,高效地进行包封率检测。而方法1)与该需求是相悖的。所以我们最先排除了它。当然,如果后续实验配方已经确定,并且需要进一步的精确测量,HPLC及LC-MS仍然可以是首选方案。
2)2,6-二氯靛酚滴定法;方法2)是国标的维生素C检测方式之一。其滴定终点会呈现淡淡的粉色(图1)。
 |
| 图1. 2,6-二氯靛酚滴定法滴定后的粉色 |
我们也按照国标检测步骤进行了测试。该方法的优点是,滴定对于乙醇,pH,甚至Triton X-100等破乳剂干扰影响不显著;同时,操作及其简便,检验快速。但对于标准品的滴定发现,即使100μL滴定量的偏差(约相当于50μg的维生素C滴定量),按要求静置15秒后粉色颜色的深浅差异也并不明显,依赖主观判断。特别是2,6-二氯靛酚滴定终点的浅粉色还会随时间逐渐消退。故该方法舍弃不用。
3)使用菲啰啉显色反应进行检测。
该方法虽对于标准品有很好的线性关系,但相关试剂的配置用到了大量乙醇,会直接导致脂质体被溶解和破坏,释放维生素C,令包封率检测结果偏低。故该方法也不适合脂质体包裹维生素C的包封率检测。
4)直接用紫外分光光度计检测。
我们对标准品进行了光谱扫描。我们发现,在稀硫酸中的维生素C的吸收峰位于243nm附近(图2.),符合文献报道的245nm吸收峰:
| 稀硫酸中维生素C的紫外吸收曲线 |
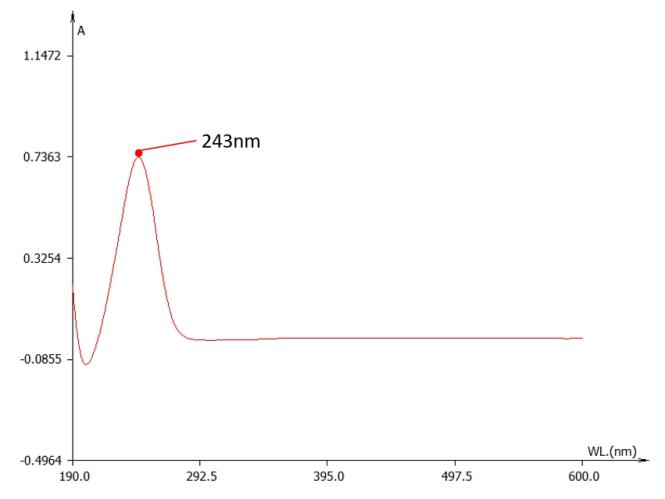 |
| 图2. 稀硫酸中的维生素C的紫外吸收曲线。横坐标为紫外光波长;纵坐标为吸光度。 |
然而溶解于PBS中的Vc吸收峰位于298nm附近;这意味着随着pH的变化,维生素C的紫外吸收峰发生红移(图3.)
| 1×PBS中维生素C的紫外吸收曲线 |
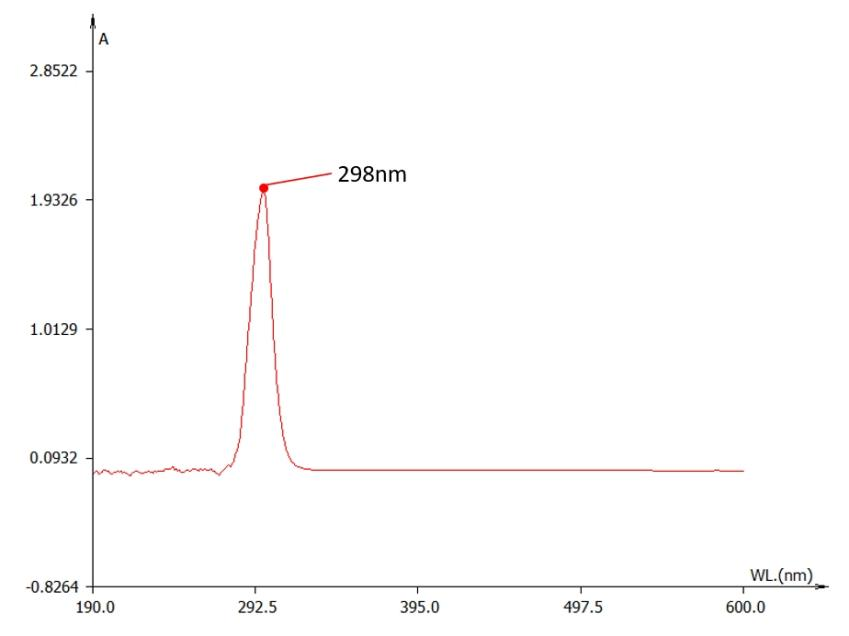 |
| 图3. 1×PBS的维生素C的紫外吸收曲线。横坐标为紫外光波长;纵坐标为吸光度。 |
我们也对空白的空载脂质体进行了紫外光谱扫描。结果显示其在295nm峰值附近有较强吸光度。
| 1×PBS脂质体的紫外吸收曲线 |
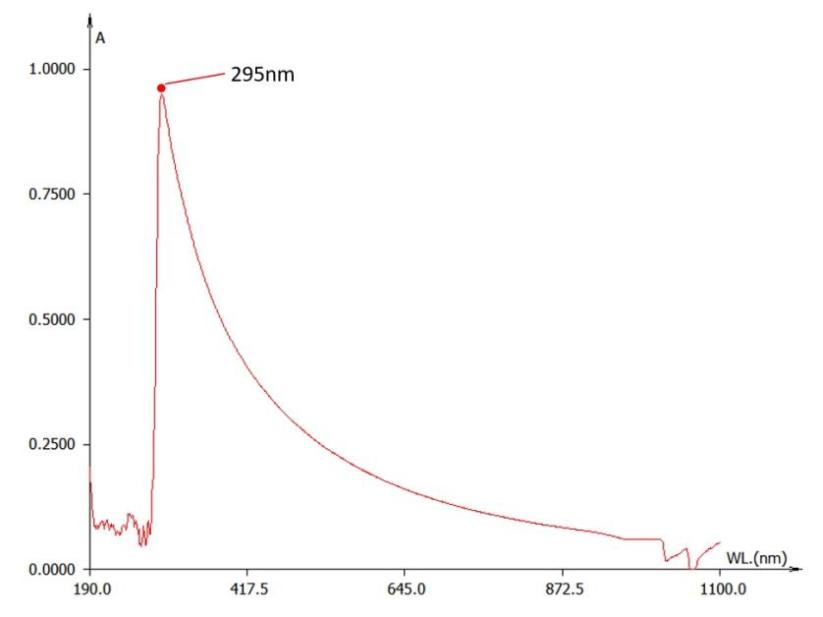 |
| 图4. 1×PBS中的维生素C的紫外吸收曲线。横坐标为紫外光波长;纵坐标为吸光度。 |
而脂质体在合成后,一般会置换和保存于PBS等中性溶液中。该峰值与红移后的维生素C重叠(图3、图4)。故该方法最终也被我们排除。
值得注意的是,图4的结果也说明,脂质体在420nm附近仍有一定的吸光度。在使用固蓝B溶液检测的时候,标准样需要加入空白脂质体以确保检测条件一致。
| 温馨提示:因内容会持续优化,如您在观看过程中发现任何问题,欢迎与FluidicLab技术专家联系,获取最新版本PDF文件。本文为FluidicLab原创出品,未经授权许可,禁止转载、片段复制改写加工。 |

































![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)



