脂质体与生物膜有较大的相似性以及组织相融性,在宿主体内可生物降解,无免疫原性;易于被组织吸收,对机体无毒或毒副作用小;有较高的靶向性。由于其独特的性质,脂质体作为载体可以包封和输送DNA/RNA、蛋白质、化学分子或其他功能物质。
脂质体作为药物载体,既具有缓释药物和降低药物毒性功能,又可以提高药物稳定性和对靶向性。而且脂质体载药过程主要为物理过程,不会改变和破坏药物分子结构与活性,且包封的药物可避免体内水解酶的破坏。因此脂质体制备及其作为药物载体的研究。
影响脂质体粒径和单分散性的参数包括脂质体尺寸及分布、磷脂组成、胆固醇含量、荷电性、包裹物性质以及包裹量等。选择合适的脂质体制备方法,可以较好地控制上述因素,从而实现对脂质体性能的控制。
临床应用的脂质体药物载体通常要求尺寸在20 ~ 200 nm 左右,尺寸均一,这种单分散脂质体药物载体可以明显提高药物的生物利用度,避免免疫细胞的清除,减小毒副作用,提高治疗的靶向性。因此制备尺寸均一、大小可控、质量可控的脂质体药物载体对研究药物输送、缓释有着重要的意义。
微流控脂质体制备技术不仅能很好地控制脂质体的尺寸均一性,而且脂质体尺寸大小、药物包封量等都可以通过改变各相流体的流动参数实现精确调控,具有显著优势。常用的微流控技术制备脂质体的方法如下:
01、流体聚焦法
流体聚焦是最常见的微流控脂质体制备方法。流体聚焦法,主要是指连续流制备脂质体。在芯片中间通道引入含二肉豆蔻酰磷脂酰胆碱(DMPC)和胆固醇的异丙醇溶液作为有机相,两侧通道引入PBS溶液,当三股流体在主通道聚焦时,脂-醇溶液被两侧水相挤压并扩散至水相形成窄的混合溶剂区。当混合溶剂区醇含量低于脂溶解所需的醇含量,磷脂会自组装形成单层小尺寸球形脂质体。脂质体的大小可通过有机相或水相流体流速调控在100-300 nm,单分散性好。

图1、 流动聚焦芯片中的乙醇相和水相。中间流道为乙醇相,上下两侧流道为水相。
流体聚焦制备脂质体具有以下几点优势:
为了更好地控制流体特性和所制备脂质体的尺寸,也可以采用一种五个进口、三个出口的微流控结构,水溶性物质直接被两侧的醇相包封,随后形成包封水溶性物质的脂质体,很大程度上减少了包封物质的浪费。
醇相与水相总流速( TFR) 与流速比(水相/醇相=FRR) 对脂质体制备的具有决定性的影响。当TFR比较小时,改变TFR但保持固定的FRR,对脂质体大小和尺寸分布影响不大;当增大FRR时,脂质体的粒径随之减小。使用流体聚焦微流控芯片,并使用不同链长的磷脂酰胆碱( PC)、胆固醇和双十六烷基磷酸( DCP) 作为制备脂质体的组分,当FRR一定时,TFR的增加会导致脂质体的增大,而且FRR数值越小,脂质体增大越明显。研究表明微流控芯片通道尺寸、深度以及几何形状对制备的脂质体性能没有显著影响,不同的芯片结构、通道尺寸以及流体聚焦模式都可以产生尺寸相似的脂质体。但通道尺寸和深度较大的芯片易于制作和操控,且制备通量更高,有利于实际应用。
通过对三进口流体聚焦型、Y型以及微混合器型等三种不同结构的芯片并从微流体通道尺寸、进口通道之间角度、芯片材料、制备方法等方面的研究发现,脂组分浓度、乙醇含量、脂组成、FR 变化等对制备的脂质体都有很大的影响。脂组分浓度的增加导致制备的脂质体粒径明显增大,而乙醇含量的影响正好相反。中性脂组分制备的脂质体粒径明显大于带正电的脂组分制备的脂质体。增大FR使脂质体的粒径变小。
温度对脂质体尺寸影响极为显著,较高温度制备的脂质体尺寸明显小于室温制备的脂质体。在醇-脂体系中,温度对脂质体的制备影响较大。
虽然二维流体聚焦对制备脂质体的分散性和尺寸大小能极好地控制,但是作为商业化手段来实现脂质体的制备仍然面临制备通量低的问题。基于此,研究者开发了三维同轴聚焦技术。
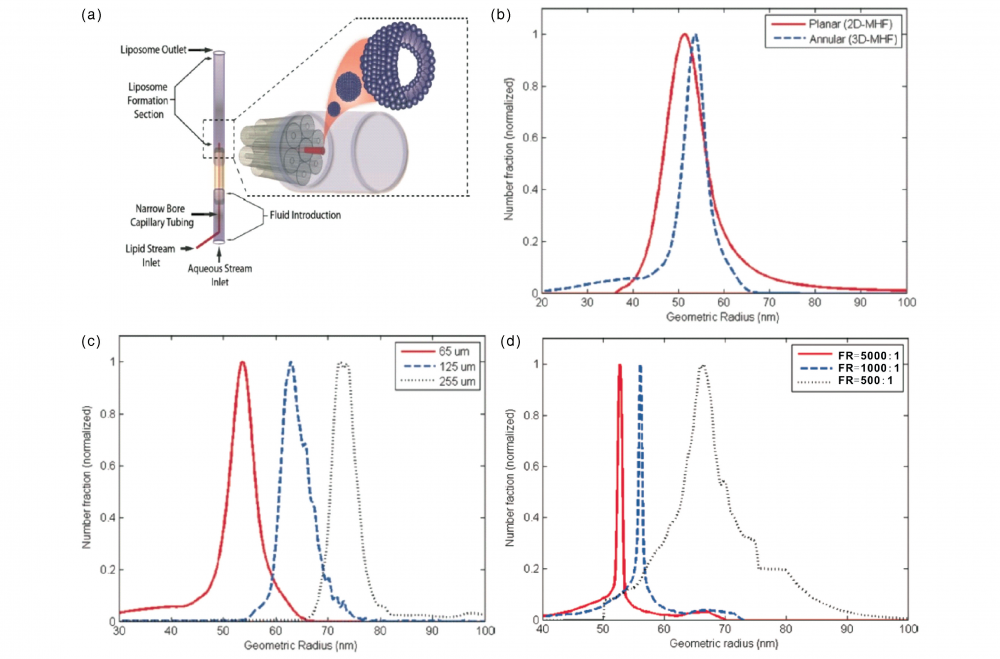
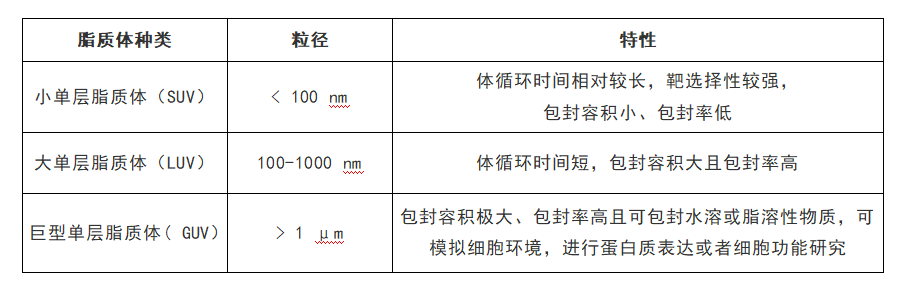
图2、 (a) 三维流动聚焦脂质体制备设备示意图; (b) 二维流动聚焦与三维流动聚焦对制备脂质体的影响; (c) 三维流动聚焦设备PEEK管内径大小对制备脂质体的影响; (d) 不同FR对脂质体制备的影响。
利用如图2所示结构,使用核-环形毛细管阵列平台形成三维流体聚焦,在连续流状态下直接制备纳米脂质体。由于多个核-环结构毛细管组成阵列,脂质体的制备效率是二维流体聚焦制备方法的10000 倍,且制备的脂质体尺寸可调,呈高度单分散性。这主要是因为在三维流动聚焦装置中,含脂的醇溶液能快速扩散至水相中。图2a是环形毛细管阵列三维流动聚焦设备示意图,中间是一根用于引入脂-醇溶液的窄口PEEK圆形毛细管,窄口毛细管周围是引入水相的玻璃毛细管阵列。在制备脂质体的时候,中间毛细管持续引入的脂-醇溶液在周围玻璃毛细管引入的水相作用下形成三维流体聚焦,并迅速扩散至水溶液中自组装形成脂质体。
02、双乳化微滴法
双乳化微滴法是一种有效制备巨型脂质体的方法。
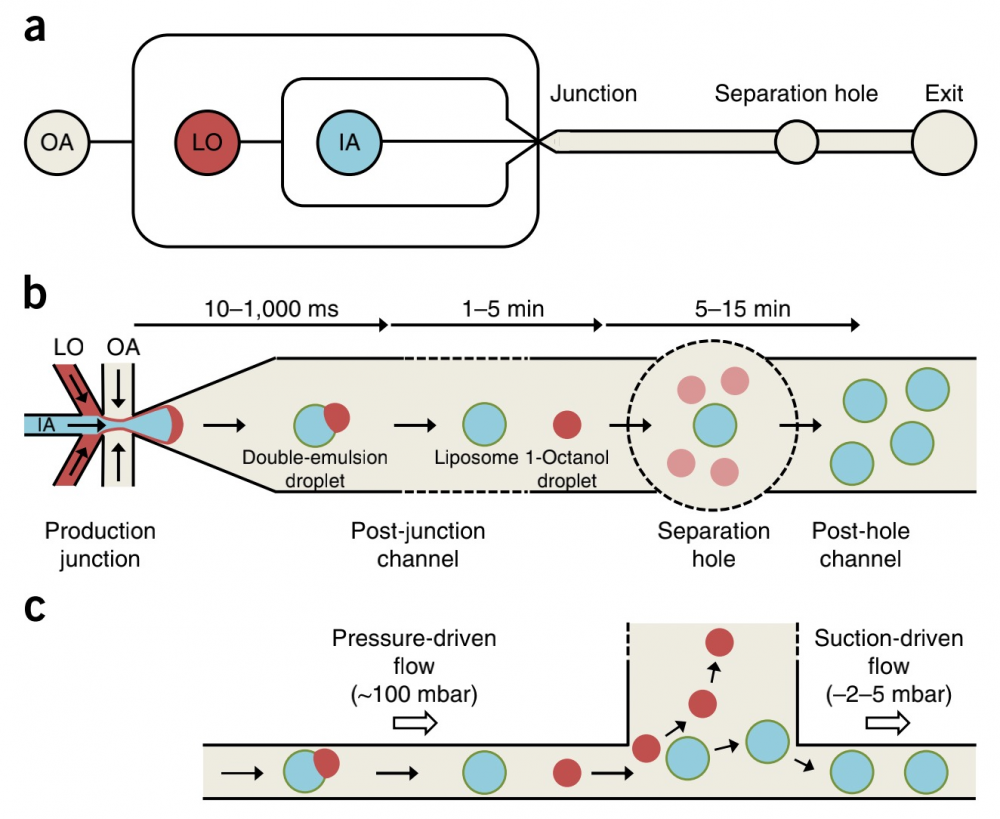
图3、 (a) 双乳化制备脂质体芯片示意图; (b) 中间溶脂有机相中通过界面脱湿过程自发形成脂质体和辛醇液滴; (c) 脂质体和辛醇微滴通过分离孔进行分离。
水-油-水( W / O / W) 双层微乳液滴法已经作为一种高效、方便的技术用于制备单分散的GUV。通常,油相为挥发性的有机溶剂,促使单层脂分布在水-油界面形成双层脂膜,排列成双层微乳,通过溶剂萃取,W / O / W 双层微乳形成脂质体( 如图3b)。Siddharth Deshpande等使用微流控平台产生双层微乳,并自发组装成GUV。 他们使用局部改性的PDMS微流控芯片制备出单分散性和稳定性俱佳的 W / O / W 双层微乳液滴。通过各相流体流量可以方便地控制双层微乳液滴的尺寸,从而得到尺寸均一、分散稳定的双层微乳液滴,进一步得到单分散的巨型脂质体。
微流控液滴法能避免诸如包封率低、非生理性环境和多分散性等难题。微流控液滴具有更大的比表面积,相比较连续流流体聚焦能够更好地控制形成的脂质体的大小和均一性,而且有很高的包封率。但是以微乳为基础的微流控液滴制备方法最大的缺陷就是需要使用与水不相混溶的有机溶剂(包括油残留或表面活性剂),而此类溶剂通常毒性较大,较难从脂质体体系中清除,并且降解活性成分,因此可能导致脂质体有毒, 从而对人体健康产生潜在风险。
03、微混合器法
流速是脂质体制备中一个非常关键的影响因素。Maeki 等设计了如图 9 所示的交叉鱼骨形微混合器的微流控芯片结构,并研究了混合器结构不同( 即混合单元数不同)、FR 不同以及醇水溶液汇合处与混合器之间距离不同对制备的脂质体的影响。研究发现混合器混合单元数目和FR大小是制备纳米脂质体的关键因素,FR由小逐渐增加至中等数值时,混合器对纳米脂质体粒径大小的影响比较明显。同时第一个混合单元的位置对于制备纳米脂质体也存在一定的影响。他们推测要形成小粒径纳米脂质体的本质是快速降低乙醇浓度至其临界浓度。利用交叉人字形微混合器结构可以高通量制备由促融脂二油酰基磷脂酰乙醇胺( DOPE) 和阳离子脂(2,3-二油氧基丙基) 三甲基氯化铵( DOTAP ) 组成的单分散阳离子纳米脂质体。制备的阳离子脂质体不仅转染效率高、重复性好,粒径尺寸和分散性则可以通过调节总流速及FR得到很好地控制。