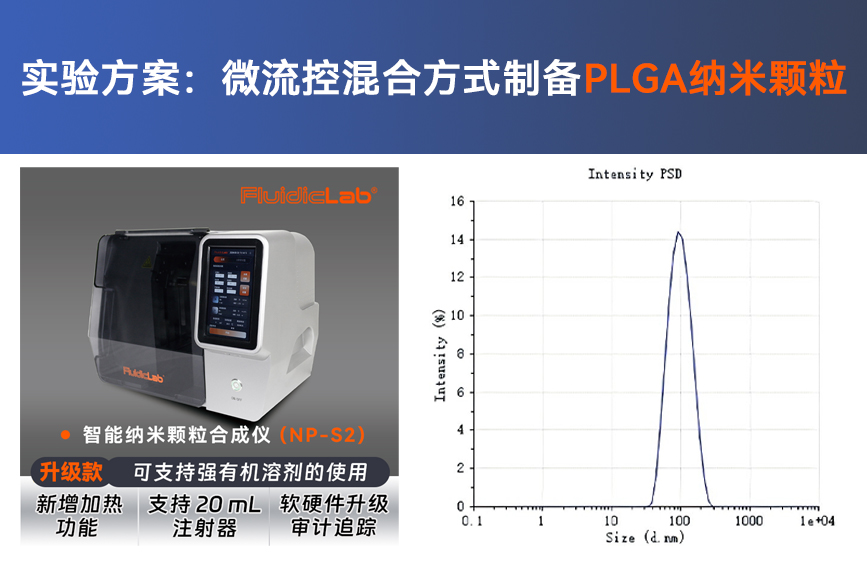
文章转载自FluidicLab客户东纳生物微信公众号“纳米岛”,原创作者Nanoeast。如有内容侵权,请联系删除!
mRNA疫苗简介
核酸疫苗作为一种被寄予厚望的疫苗形式,相较于传统的基于生物的疫苗(如减毒活疫苗、灭活疫苗等),工艺简单,合成时间短,安全性高。与DNA疫苗相比,mRNA不用进入细胞核,低剂量就能刺激机体产生足够的中和抗体。而且,mRNA不会整合到宿主细胞的基因组上,避免了可能的突变。传统的蛋白免疫接种只能启动CD4+T细胞(辅助性T细胞,Th细胞)介导的体液免疫,mRNA疫苗能激活更强烈的CD8+T细胞(细胞毒性T细胞,Tc细胞)介导的细胞免疫。因此,不论是安全性还是有效性,mRNA疫苗都略胜一筹。但是mRNA半衰期短,稳定性差,易被核酸酶降解失去疗效,体内递送效率较低,分子量和负离子性质也为它进入细胞膜屏障带来了巨大阻碍,如何顺利将mRNA完整且高效地递送进细胞成为一个重要议题。
非病毒载体主要包括脂质纳米颗粒(Lipid nanoparticles,LNP)、树状大分子、无机纳米粒子、阳离子细胞穿膜肽等,其中LNP递送mRNA具有独特优势:首先,LNP为球形颗粒,可将 mRNA 包裹在内,抵御核酸酶的作用;其次,LNP成分与细胞膜类似,易与受体细胞融合,转染效率高,并且不受宿主限制,可以递送不同大小片段的mRNA。
图1:LNP递送和作用原理。封装在LNP中的S蛋白mRNA被递送进细胞后,在核糖体中合成S蛋白。一部分S蛋白被细胞内的蛋白酶体切割成大大小小的肽段,与内质网上的组织相容性复合物MHCⅠ类分子结合,通过胞吐呈递到细胞表面,被CD8+T细胞识别,启动细胞免疫,即“内源性抗原”识别途径。另一部分S蛋白被分泌到胞外,被巨噬细胞等抗原呈递细胞吞噬,在溶酶体内分解成小肽段,与另一种组织相容性复合物MHCⅡ类分子结合,呈递到细胞表面,被CD4+T细胞识别,启动体液免疫,即“外源性抗原”识别途径。 图片来源:Pharmaceutics
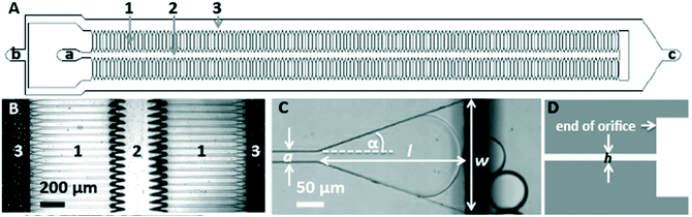
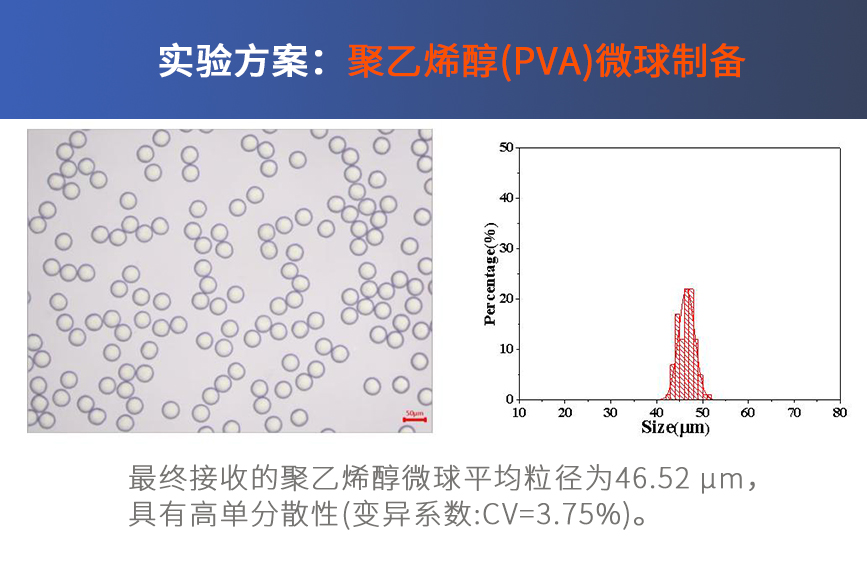
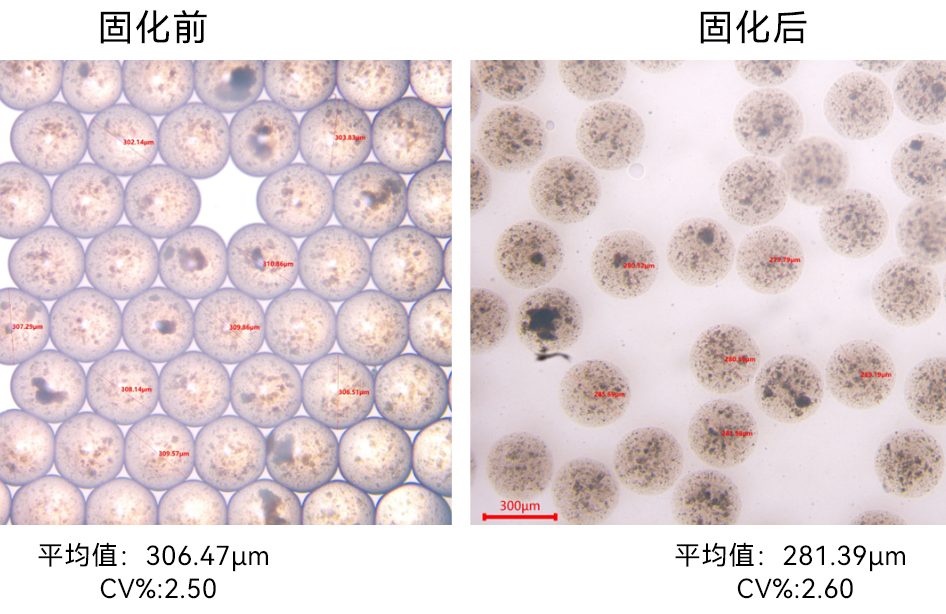
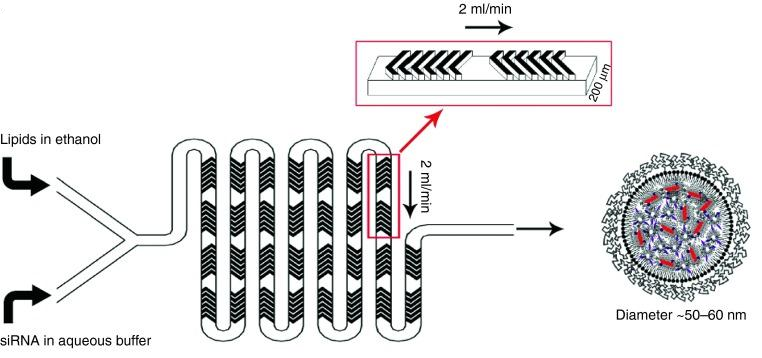
LNP制备方法
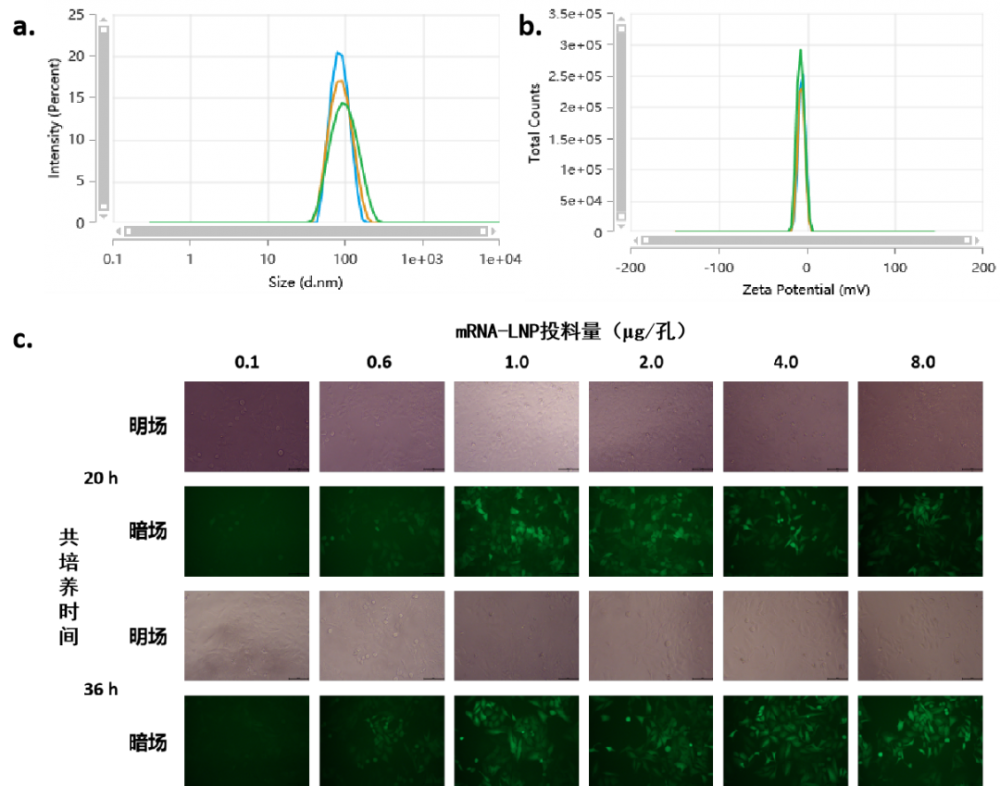
LNP测试与转染