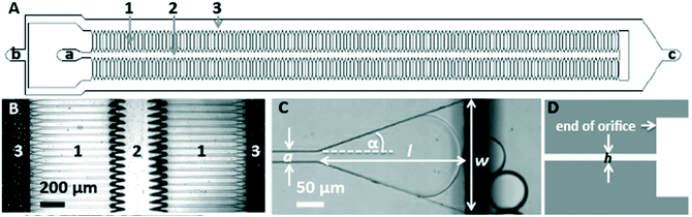
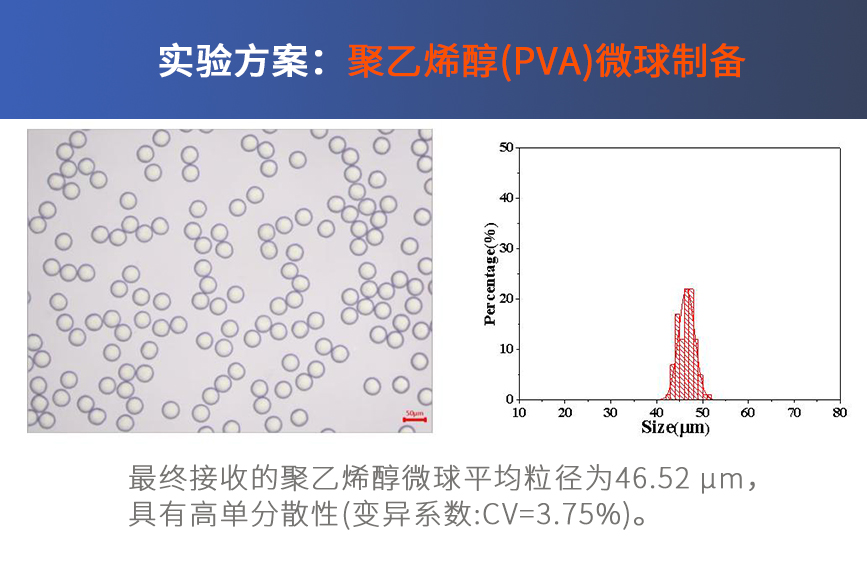
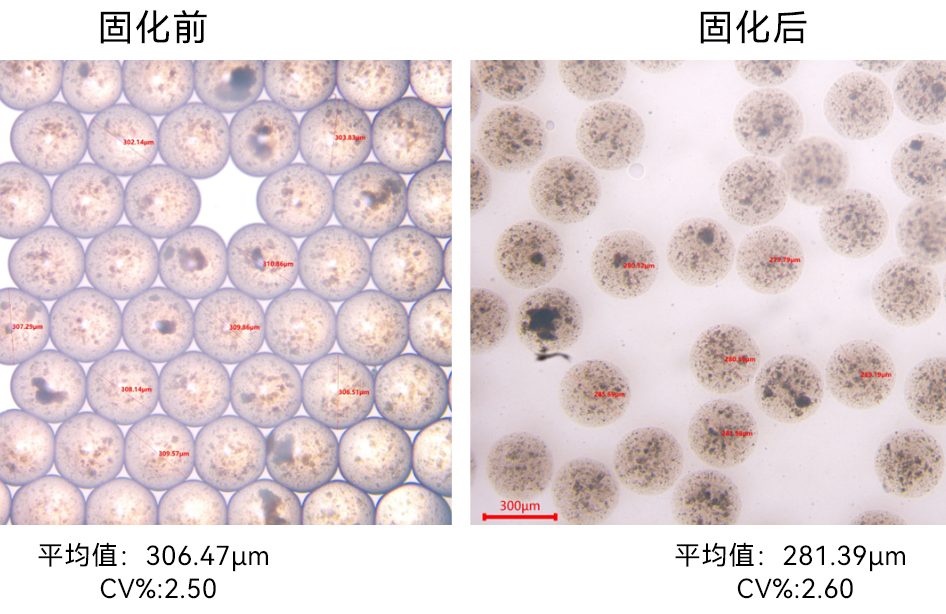
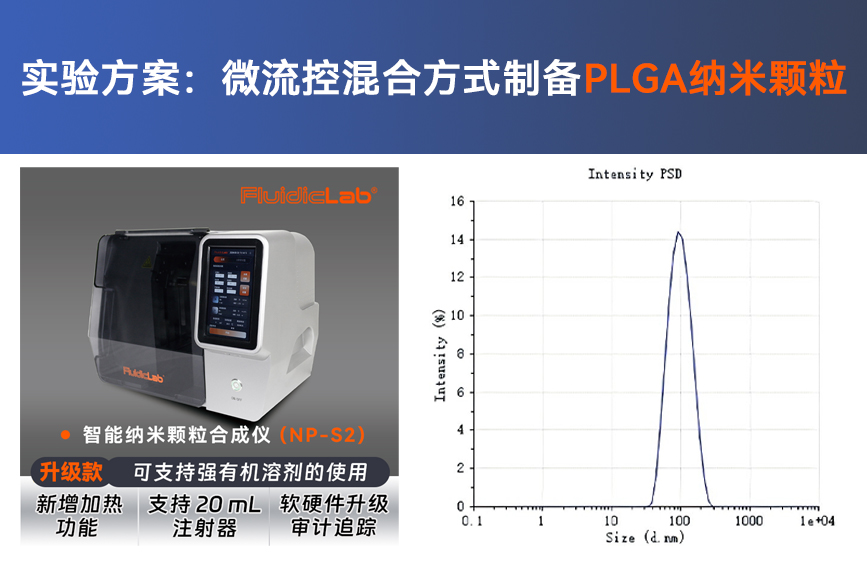
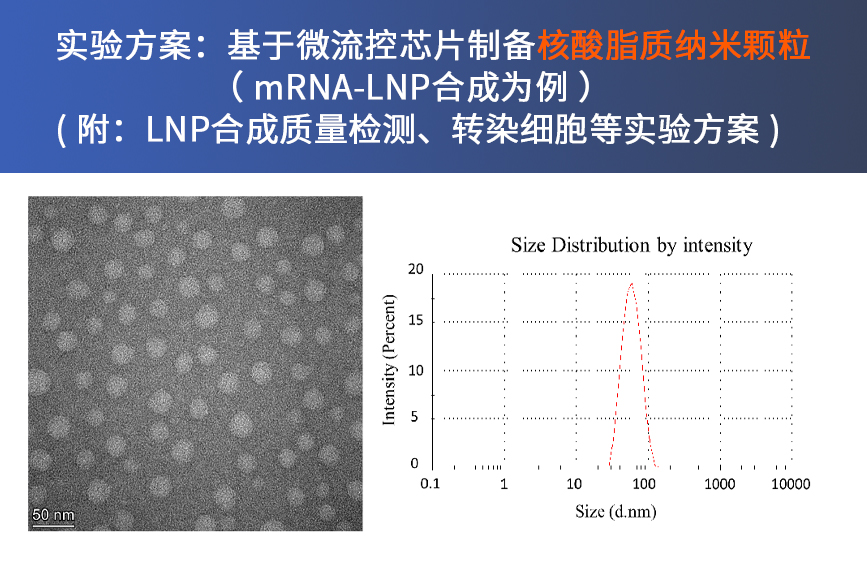
一、使用LNP-B0芯片按照Moderna或者Pfizer的公开配方制备mRNA-LNP,DLS测量出现两个峰,一个小于100 nm,另外一个峰大于1000 nm的峰,并且PDI大于0.2以上,应该如何处理?
答:出现这种情况一般有三个原因:
1. 进行DLS测量时测量杯壁上有划痕,对于多次反复重复使用,并反复用吸水纸擦拭的测量杯,该现象更加明显。当激光打在测量杯表面时,测量杯表面会发生激光散射,造成测量有大颗粒的假象。
2. 总流速太快,水和乙醇高速混合时会有气泡产生,测量时溶液中有微气泡残余。
3. 30倍稀释后的LNP粒子浓度太低,背景信号占比比较高,造成PDI过大。
处理方法:
1. 一般不需要做额外处理,只要小于100 nm的峰形正常,经过超滤浓缩后的LNP重新测量,大于1000 nn的峰基本上就会消失,PDI会降低到0.1左右,不会影响后续实验。
2. 如果该情况继续出现的话,降低总流速到3-4 ml/min,观察是否有改善。
二、 制备的LNP粒径和PDI均比较正常,但是转染细胞后效率很差,应该如何处理?
答:一般使用包含GFP mRNA的LNP转染细胞后两天内即可观察到明显的荧光,以96孔板为例,单孔转染对应1 ug mRNA的LNP(最低可降低到0.1 ug), 转染效率普遍在70%以上,如果没有观察到明显的荧光,建议转染细胞时使用无血清培养基。加入血清会大大降低转染效率。