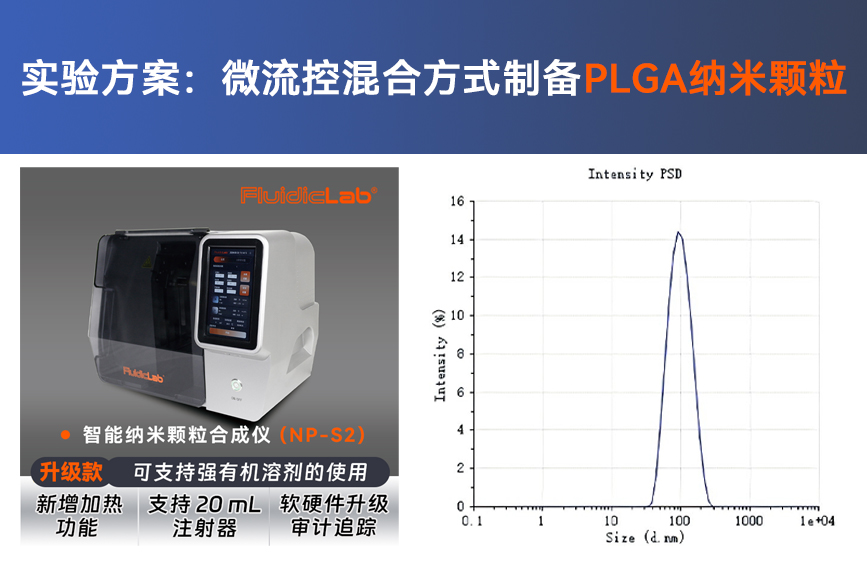
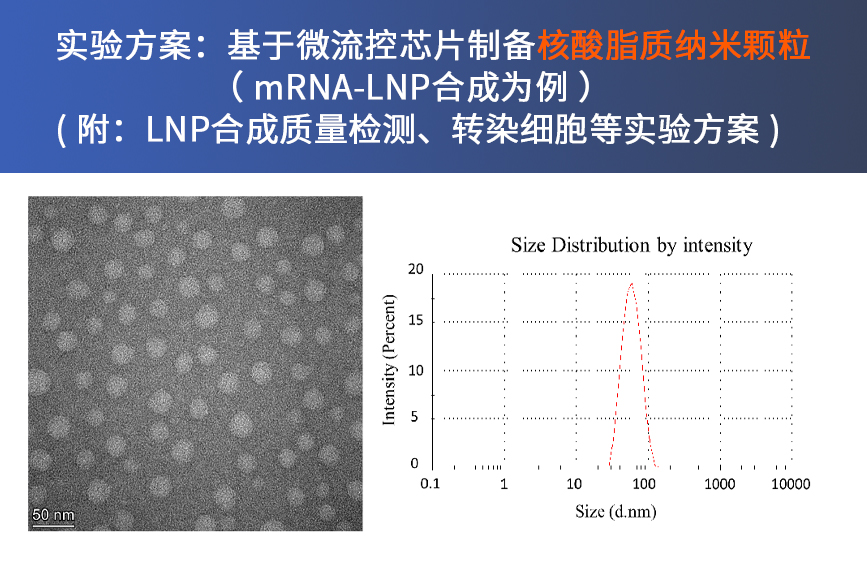
实验目的:
本实验方案参照10X Genomics的barcode凝胶珠制备方法,以微滴/微球制备仪为驱动装置,以丙烯酰胺混合液为水相(分别以丙烯酰胺和N,N′-双(丙烯酰)胱胺作为单体和交联剂),以含有N, N, N′, N′-四甲基乙二胺的Drop-Surf微滴生成油为油相,制备含有Oligo DNA的高单分散可降解聚丙烯酰胺凝胶珠(CV<5%),封装前后Oligo DNA浓度交联率高达40%以上。
引言:
细胞作为生物结构和功能的基本单位,在形态类型上差异很大。结合高通量测序,基于液滴的单细胞测序技术被成功应用于分析单细胞中的RNA[1-3]、DNA[4,5]和蛋白质[6,7]等组分。为了标记追踪单个细胞,需要将含有DNA barcode的凝胶珠与单个细胞共同封装在纳升级的液滴中,以便用于后续的单细胞分析测序[8]。而如何将合成的DNA barcode添加到凝胶珠上是实现这项技术的关键。现已报道的制备添加DNA barcode的方法有inDrop单细胞测序的聚丙烯酰胺胶珠[2]、Drop-seq单细胞测序的羟化甲基丙烯酸聚合物凝胶珠[3]和10X Genomics使用的聚丙烯酰胺凝胶珠[8]等。
然而,上述方法制备的胶珠由于化学成分不同,其优缺点有明显差异。例如,inDrop系统中可实现95%以上的胶珠包裹率,但DNA barcode的释放需要通过紫外线辅助释放,这在一定程度上增加了引物的释放难度[2]。同时,紫外线也有可能对DNA或RNA造成不可逆的伤害。Drop-seq系统中虽无上述问题,但引物不会从胶珠中释放,这使得反应仅在胶珠表面进行,降低了反应效率。在10X Genomics系统中,胶珠可以实现有效的包裹和释放,但相对较高的成本和胶珠上引物设计缺乏灵活性限制了一些实验的开展。因此,当前的主要难点是制备出简易高效向液滴输送含有barcode胶珠,从而实现高检测效率。
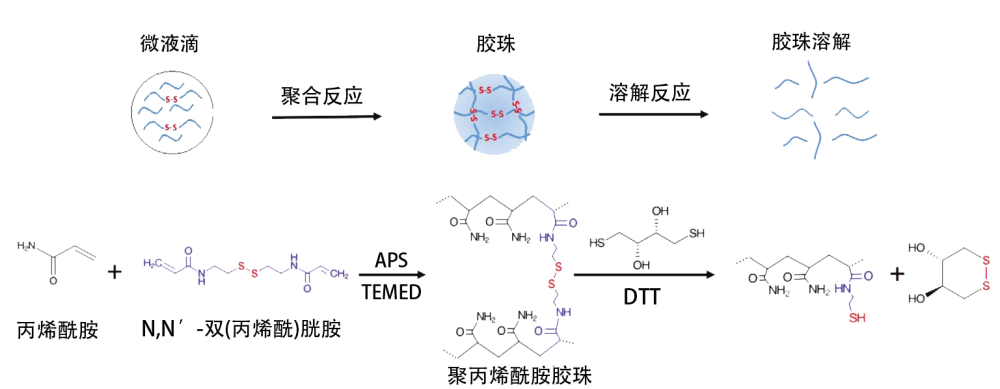
FluidicLab基于Wang等人的研究[9],参照10X Genomics的barcode凝胶珠制备方法,提供了一种含有Oligo DNA聚丙烯酰胺可降解凝胶珠的实验方案。本实验方案以丙烯酰胺混合液为水相(分别以丙烯酰胺和N,N′-双(丙烯酰)胱胺作为单体和交联剂),以含有N, N, N′, N′-四甲基乙二胺的Drop-Surf微滴生成油为油相,制备含有Oligo DNA的高单分散可降解聚丙烯酰胺凝胶珠。所制备的胶珠可以通过二苏硫醇(DTT)打开交联剂N,N′-双(丙烯酰)胱胺中的二硫键,使得其被完全降解,从而释放出DNA barcode(机理如下图所示[9],发生聚合反应时以过硫酸铵(APS)作为催化剂,N, N, N′, N′-四甲基乙二胺(TEMED)作为催化加速剂),通过检测封装前后Oligo DNA浓度可知其交联率高达40%以上。
实验材料:
| 试剂 | 微滴生成油(Drop-Surf, FluidicLab)
破乳剂(Drop-Surf, FluidicLab) TBSET缓冲液(FluidicLab) 40%丙烯酰胺溶液(wt%, FluidicLab) 0.8% N,N′-双(丙烯酰)胱胺溶液(wt%, BAC, FluidicLab) 过硫酸铵(APS, FluidicLab) N, N, N′, N′-四甲基乙二胺(TEMED, FluidicLab) 1% Span 80的正己烷溶液(v/v, FluidicLab) TET缓冲液(FluidicLab) Qubit ssDNA检测试剂盒(Thermo Fisher Scientific) 10 mM 二苏硫醇溶液(DTT , FluidicLab) |
| 耗材 | 15 mL离心管(Falcon 15 mL REF 352097)若干
1.5 mL离心管若干 内/外径0.25 /1.6 mm PEEK管及所需接头 0.22 μm针式过滤器(PTFE材质)若干 |
| 芯片夹具 | PDMS-FF-50 μm 超疏水芯片(FluidicLab)
PDMS标准芯片夹具 |
| 设备 | Fluidiclab微滴/微球制备仪(两通道) |
| 辅助设备 | 电脑(Win10 以上系统)
高速离心机(湖南湘仪, H1850) 普通光学显微镜(用于测微球粒径) Qubit 4荧光检测仪 |
实验步骤:
1.试剂配制:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备含Oligo DNA的可降解凝胶珠”):
(1) 10%(w/v)过硫酸铵溶液配制:
称量约0.1 g 过硫酸铵,加入超纯水振荡溶解,最终定容至1 mL备用。
(2) 含有Oligo DNA的水相配制
依次取200 μL TBSET缓冲液、300 μL 40%(wt%)丙烯酰胺溶液、980 μL 0.8% (wt%) N,N′-双(丙烯酰)胱胺溶液和120 µL 10%(w/v)过硫酸铵溶液混合均匀,并用0.22 μm的针式过滤器过滤处理备用;
再依次取上述配制好的800 µL丙烯酰胺混合液、166 µL 浓度为150 µM的Oligo DNA和34 µL超纯水混合均匀得到1 mL含有Oligo DNA的水相溶液,最终配制成分如下表所示:
| 项目/单位 | 初浓度 | 加入量(μL) | 终浓度 | |
| 丙烯酰胺混合液 | TBSET缓冲液 | / | 100 | / |
| 丙烯酰胺溶液(wt%) | 40% | 150 | 6% | |
| N,N′-双(丙烯酰)胱胺溶液(wt%) | 0.80% | 490 | 0.392% | |
| 过硫酸铵(w/v) | 10% | 60 | 0.60% | |
| Oligo DNA | 150 μM | 166 | 25 μM | |
| 超纯水 | / | 34 | / | |
(3) 水相中Oligo DNA浓度的检测:
取5 µL上述配制的含有Oligo DNA水相溶液,加入45 µL超纯水将其稀释10倍,振荡均匀备用;
依次取298.5 μL Qubit ssDNA Buffer和1.5 μL Qubit ssDNA Reagent混合均匀得到Qubit ssDNA检测试剂备用。
依次取上述配制的199 μL Qubit ssDNA检测试剂和1 μL 上述配制的含有Oligo DNA的水相稀释液混合均匀,并静置2 min;用Qubit 4检测其浓度。
(4) 油相配制:
按1000:4 (v/v)的体积比在3 mL微滴生成油中加入12 μL TEMED,并振荡均匀。
2.含有Oligo DNA胶珠的制备和固化:
(1) 、微滴/微球制备仪的安装连接
微滴/微球制备仪安装连接参考《微滴/微球制备仪使用手册V.1.0》中“2. 微滴/微球制备仪的安装连接”的部分;其连接如下(步骤③-⑦连接效果如下图所示):
① 用气管依次连接“空气压缩机”--“气源处理装置”--“微滴/微球制备仪”;
② 将微滴/微球制备仪分别与电源、电脑的连接;
③ 用气管分别将A0(压力输出通道一)和A1(油相15 mL储液池),B0(压力输出通道二)和B1(水相1.5 mL储液池)连接;
④ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A1(油相15 mL储液池)和A2(通道一流量传感器),B1(水相1.5 mL储液池)和B2(通道二流量传感器)连接;
⑤ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A2(通道一流量传感器)和A3(PDMS芯片的油相入口),B2(通道二流量传感器)和B3(PDMS芯片的水相入口)连接;
⑥ C为标准PDMS-FF-50超疏水芯片和夹具组合,芯片和夹具的入口通过硅胶塞密封;
⑦ 用PEEK管(内/外径 0.25 mm/1.6 mm)将芯片出口D处生成的乳液导出。
(2)、 FluidicLabSuite软件的安装和设备的添加:
FluidicLabSuite软件的安装参考《微滴/微球制备仪使用手册V.1.0》中“3.1 FluidicLabSuite软件的安装”的部分;
(3)、含有Oligo DNA胶珠的制备和固化:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备含Oligo DNA的可降解凝胶珠”):
① 在通道一的储液池(油相)中加入上述配制的油相,通道二的储液池(水相)中加入上述配制的含有Oligo DNA的水相;
② 打开空气压缩机及气源处理开关;
③ 在电脑端设置通道一(油相)和通道二(水相)压力排出管路及芯片中的空气,待空气排出(管路及芯片充满液体)后,设定油相和水相流速分别为20和10 μL/min;
④ 按《微滴/微球制备仪使用手册V.1.0》调整流速增加反馈值(Feedback)以快速达到预定设置值;
⑤ 待微液滴生成稳定后,用疏水培养皿接收液滴用并显微镜观察其均匀性;
⑥ 微液滴稳定生成后,即可开始接收至离心管中,20 min后停止收集;
⑦ 将接收至离心管中的乳液表面覆盖200 μL 矿物油,并放置于65 °C鼓风干燥箱中过夜固化。
3. 含有Oligo DNA胶珠的破乳清洗:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备含Oligo DNA的可降解凝胶珠”):
① 取出1.5 mL离心管底部油相和上层矿物油;
② 按V球 : V = 1:2 加入破乳剂,振荡破乳;5000 rpm离心处理30s,取出底部废液;重复上述操作2~3次,直到微球由乳白色变为透明;
③ 按V球 : V = 1:2 加入 1% Span80的正己烷溶液,振荡均匀;5000 rpm离心处理30s,取出上部废液;重复上述操作2~3次;
④ 按V球 : V = 1:3 加入TET缓冲液,振荡均匀,5000 rpm离心处理5min,取出上层废液;重复上述操作1~2次;
⑤ 最终分散于TET缓冲液中,得到固化后的聚丙烯酰胺微球。
- 胶珠中Oligo DNA浓度检测:
具体操作步骤如下(参考视频“微流控应用:微滴制备仪制备含Oligo DNA的可降解凝胶珠”):
① 取5 µL上述制备的胶珠,加入45 µL浓度为10 mM的DTT溶液,振荡均匀,静置约10 min,等待胶珠完全溶解;
② 配制Qubit ssDNA检测试剂,依次取298.5 μL Qubit ssDNA Buffer和1.5 μL Qubit ssDNA Reagent混合均匀;
③ 依次取上述配制的199 μL Qubit ssDNA检测试剂和1 μL 上述上述配制的胶珠溶解液混合均匀,并静置2 min;
④ 用Qubit 4检测其浓度。
5. 微滴/微球制备仪清洗:
微滴生成仪每次使用完必须清洗管路、流量传感器和芯片。具体操作详见“微滴/微球制备仪操作指导卡”。
结果与讨论:
① 用Qubit 4检测上述配制水相中的Oligo DNA浓度,仪器显示结果为14.9 μg /mL
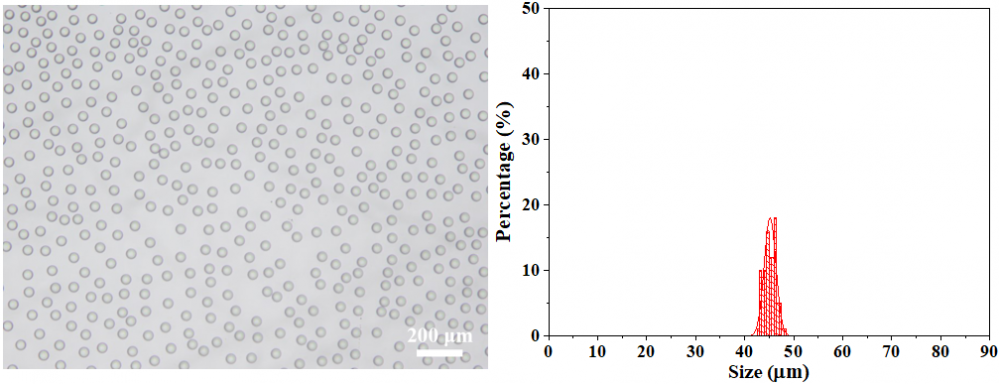
② 刚接收的微滴平均粒径为45.16 μm,具有极高的单分散性(变异系数:CV=2.65%)。其显微镜图和粒径分布如下图所示:
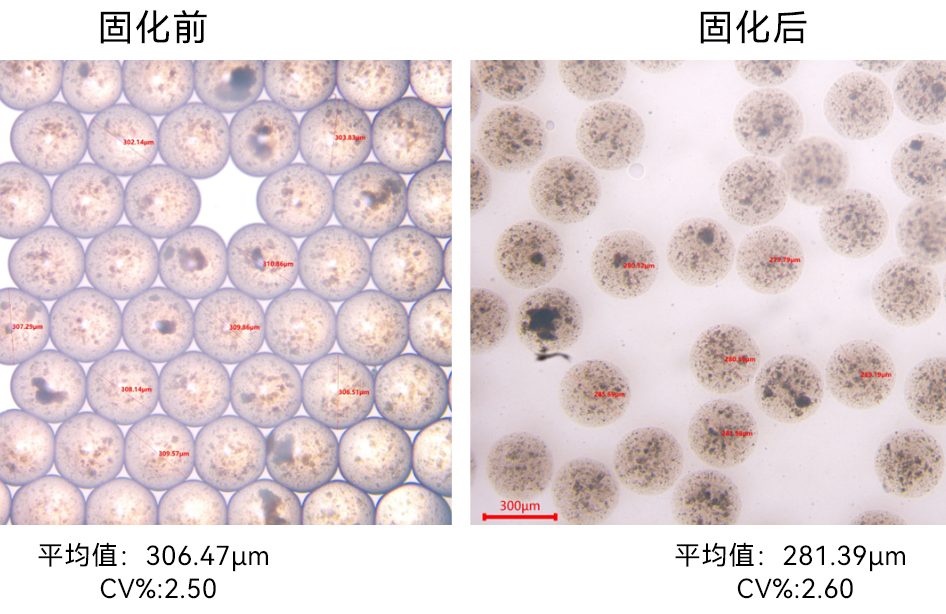
③ 固化后,最终获得的含有Oligo DNA胶珠的平均粒径为53.64 μm,具有极高的单分散性(变异系数:CV=3.88%)。其显微镜图和粒径分布如下图所示:
④ 用Qubit 4检测上述溶解后胶珠中的Oligo DNA浓度,仪器显示结果为6.48μg /mL (10.58 μM,单位转换公式: )。
)。
⑤ 通过检测封装前后Oligo DNA浓度可知其交联率高达44.35%。
参考文献:
[1] Prakadan M., et al. Scaling by shrinking: empowering single-cell'omics' with microfluidic devices, Nat. Rev. Genet., 18, 345 (2017).
[2] Klein A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells, Cell, 161, 1187 (2015).
[3] Macosko E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets, Cell, 161, 1202 (2015).
[4] Lan F., et al. Single-cell genome sequencing at ultra-high-throughput with microfluidic droplet barcoding, Nat. Biotechnol., 35, 640 (2017).
[5] Lareau C. A., et al. Droplet-based combinatorial indexing for massive-scale single-cell chromatin accessibility, Nat. Biotechnol., 37, 916 (2019).
[6] Stoeckius M., et al. Simultaneous epitope and transcriptome measurement in single cells, Nat. Methods, 14, 865 (2017).
[7] Peterson V. M., et al. Multiplexed quantification of proteins and transcripts in single cells, Nat. Biotechnol., 35, 936 (2017).
[8] Zheng G. X. Y., et al. Massively parallel digital transcriptional profiling of single cells, Nat. Commun., 8, 14049 (2017).
[9] Wang Y., et al. Dissolvable polyacrylamide beads for high-throughput droplet DNA barcoding, Adv. Sci., 7, 1903463 (2020).