➤ 1.引言
作为生命的物质基础,蛋白质参与了体内细胞的生长和黏附、免疫应答和催化等过程,是生命活动的主要承担者
[1]。在内部基因和外界环境的共同作用下,蛋白质表达与否及表达量的差异将直接影响着疾病发生、神经传导和免疫应答等
[2]。因此,蛋白表达分析对分子机制研究、疾病的临床诊断和治疗以及药物的开发等方面都极其重要
[3]。早期的蛋白组学分析方法如质谱、免疫分析和双向电泳等技术,往往需要大量的细胞,检测结果反映的是细胞群体的平均蛋白表达水平
[4]。然而,拥有相同基因组信息的细胞在蛋白表型上存在显著的异质性。基于组织水平的蛋白组分析更易忽略细胞个体间的差异,而细胞的异质性在癌症转移和干细胞分化等方面起至关重要的作用
[5]。随着技术的发展,更多的研究结果表明单细胞中DNA、mRNA转录和蛋白表达水平相关性较差,这严重限制了从DNA和mRNA角度来评估蛋白质组学信息的能力
[6,7]。
对于一个细胞水平的生物过程,往往是由多个基因之间相互作用的结果所致。因此,单细胞水平上的蛋白表达研究更能揭示大量不能通过单个基因或组织水平研究解释的现象,是理解基因组与细胞反应之间的重要桥梁。单细胞蛋白组分析能够从大量细胞中区分和识别那些罕见但重要的细胞,有助于临床诊断、药物研发和某些重要的分子机制的研究
[5]。与基因表达分析相比,测定单细胞中蛋白组的难点在于蛋白质种类复杂,且含量非常低,蛋白质无法像DNA和RNA那样能以极快的速度实现扩增
[7,8]。因此,单细胞蛋白组分析应当具备多重分析性能、高吞吐量和高灵敏度等特点
[9]。在这其中,多重分析性能决定了单细胞蛋白组中的蛋白数量,吞吐量决定了并行分析的细胞数量,灵敏度决定了检测分析样本的浓度下限
[4]。而在这方面,基于质谱的无抗体标记技术有望解决单细胞蛋白组学面临的以上问题。最近有文献报道指出,采用新兴的单细胞蛋白组学质谱技术(SCoPE-MS)及其第二代(SCoPE2)技术可以实现对数百个单细胞样本中数千个蛋白进行定量分析
[10]。然而,单细胞蛋白组学仍存在一些问题,如单细胞样本与设备连接困难,样本处理需精度高(样本微小损失会严重影响检测结果),需同时对大量单细胞进行分析以减少固有噪声等
[11,12]。以上这些问题无法通过简单的修改传统的基于单细胞蛋白组分析的方法和常规样品处理技术很难解决。
微流控是一种对微纳米尺度上的流体进行控制新兴技术
[13]。微流控芯片中流道微米级尺寸恰好与细胞匹配,这使得微流控成为单细胞分析(包括单细胞蛋白组分析)的理想平台
[14]。微流控技术本身虽不是一种分析手段,但它能有效避免样品过度稀释(降低检测限),显著提高了样品吞吐性能(以便获得足够数据进行重要统计),并大幅度降低了成本,是一种有效的单细胞蛋白组学分析方法
[15, 16]。近年来,基于微流控的各种不同单细胞蛋白组学分析方法不断被报道,且部分方法已实现商业化。因此,本文将着重对最新报道的方法、及应用和优缺点进行系统的阐述,并对目前的商业发展进行简要回顾。
2.1 单细胞条码芯片
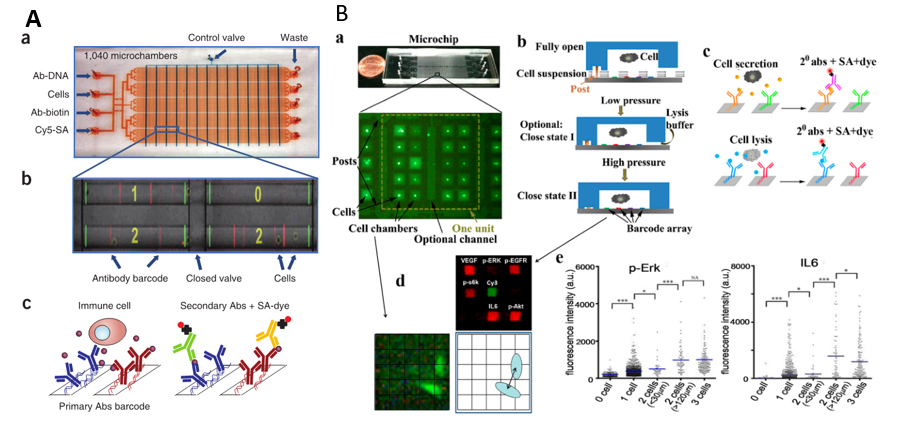
为了对单细胞蛋白组进行全面的分析,Ma等开发了一种基于阀门控制的PDMS单细胞条码芯片(single-cell barcode chip, SCBC)
[17]。此芯片由一张装有13组垂直阀门的PDMS层、一张含有80组水平的微通道(横截面尺寸为100 µm × 17 µm) PDMS层和一张具有条码阵列的玻璃基底三部分自上而下组装而成(图1A-a)。通过将上层和中层的两个PDMS层交错以形成1040个微室用于载入单个细胞。下层玻璃基底上的条码阵列是一条条平行条带,每一条带首先利用DNA编码抗体文库(DNA-encoded antibody library, DEAL)法
[18]结合特异性抗体,即分别将不同序列的单链DNA分子固定在不同条带上(条带表面有聚胺涂层),再利且碱基对互补作用连接上偶联了抗体的另一条单链DNA分子,这一作法避免了抗体直接连接降解的问题;然后,利用控制阀门将细胞随机载入一千多个微室中,每个微室载入的细胞个数从零到几个不等,其细胞载入数量符合泊松分布(图1A-b);分散于各个微室中的单细胞分泌的蛋白继而由微室内特定DNA编码的抗体库所捕获;随后,捕获的蛋白会通过三明治法进行荧光免疫分析测定,也即是捕获的蛋白与生物素标记的抗体结合,再利用链霉亲和素进行荧光标记,最终通过荧光强度对蛋白组进行检测分析(图1A-c)。结果表明,这种方法具有高的样品效率和高的灵敏度,能同时定量检测十多种单细胞分泌蛋白组,并提示了表型相似T淋巴细胞的高度功能异性。在此基础上,该方法经过改进被用于各种单细胞分泌蛋白的定量研究,如人类肿瘤细胞系
[19]和原代细胞
[20]。为了进一步提高单细胞蛋白组多重分析性,Lu等将空间和光谱编码与PDMS微腔相结合,能实现同时对单细胞分泌的42种免疫效应蛋白进行检测
[21]。此外,也有报道利用SCBC芯片用于单细胞分泌蛋白对细胞间相互作用以及信号转导影响的研究
[22,23]。
除了单细胞分泌蛋白组分析外,Wang等将该法扩展到基于无阀控制的SCBC来分析检测单细胞(包括膜蛋白、细胞内和分泌蛋白),以此量化细胞间相互作用
[24](图1B)。此芯片由一张含有8700个微室的PDMS层和一张具有高密度条码阵列的玻璃基底组成。上层PDMS层的8700个微室共被分成435组(20个/组),在每组的中间位置有一条贯穿的微通道,微通道两侧各分布10个微室(图1B-a)。PDMS层与具有条码阵列的玻璃基底键合时主要是通过可压缩变形(利用压力改变)的微柱接触。如图1B-b所示,在无压力状态(Fully open)下,向SCBC中通入足够数量的细胞以确保每个微室随机载入0~3个细胞;载入细胞后调整压力使微柱变形收缩至Close state II以此封装细胞于微室内培养;经培养一段时间,期间单细胞分泌蛋白被特定的抗体阵列所捕获(图1B-c)。而关于细胞质或膜蛋白组分析,首先施加压力使微柱处于Close state I,在微通道内通入裂解缓冲液裂解细胞,而裂解缓冲液会被引入微室内(此时状态细胞无法移动到微室外);细胞裂解后的细胞质或膜蛋白组同样被特定的抗体阵列所捕获,然后通过荧光免疫分析对蛋白组进行测定(图1B-c)。结果表明,在一定培养时间内,细胞在短距离时会产生抑制作用,在较大距离时主要产生激活作用。
图1 | A、用于单细胞分泌蛋白组分析的SCBC设计图:a. SCBC装置图,b. 微室放大图(图中数字代表微室中细胞数),c. DEAL法捕获分泌蛋白进行免疫测定;B、用于单细胞综合蛋白组分析的SCBC设计图:a. 无阀控制的SCBC装置图,b. 单细胞分析流程图,DEAL法捕获分泌蛋白、细胞质蛋白或膜蛋白进行免疫测定,c. DEAL法捕获蛋白进行免疫测定,d. 微室放大图,e. SCBC对分泌(IL6)和细胞质(p-Erk)蛋白的荧光数据。
此外,有关罕见细胞纯化以及蛋白组学分析也有报道。如Shi课题组设计开发了一种结合SCBC集成的微流控系统应用于罕见单循环肿瘤细胞(CTCs)纯化及分泌蛋白组学分析研究
[25]。CTC分离纯化和单细胞蛋白组分析的整个系统主要包括:CTC捕获芯片(包括紫外灯)、红细胞(RBC)捕获芯片、白细胞(WBC)捕获芯片和SCBC芯片(图2A)。其原理如图2B所示,将含有单链ssDNA编码特异性抗体(含有光解连接物)标记的CTC全血样本通入CTC捕获芯片中,而CTC表面的单链ssDNA会与芯片上固定的单链ssDNA互补而被捕获;待细胞被捕获后,将CD45(普通白细胞抗原)和CD15(粒细胞标记物)包被的免疫磁珠的混合物通入芯片中,并与非特异性结合的白细胞结合;随后将芯片暴露在紫外灯下短时间暴露以将释放固定在芯片中的CTC;接着将其流入到RBC捕获芯片即螺旋芯片中,通过调控流速(控制离心率)以除去RBC;然后将其流入到WBC捕获芯片,利用磁铁除去与磁珠结合的WBC;最后,将高纯度的CTC流入到SCBC芯片,以便使得集成的聚赖氨酸(PLL)条形码对单个CTC进行捕获来完成分泌蛋白组学分析研究。在这其中,合成可光降解的单链ssDNA编码特异性抗体是为了在不损害细胞活力下高效捕获和释放CTC。结果表明,这种结合SCBC芯片集合的微流控系统有效的实现了对CTC的分离和纯化,且CTC表现出高度的异质性。
图2 | A、实验装置和微流控芯片;B、CTC分离纯化和单细胞分泌蛋白分析的示意图。
采用SCBC分析具有样本量小、灵敏度高、范围广(包括膜蛋白、胞内和分泌蛋白)和多重分析能力等优点。尽管如此,但它仍有一些问题需要改进。如芯片的微阀制造复杂,操作复杂,有限的条码微芯片面积限制了其检测的吞吐量等。此外,多重分析能力与检测灵敏度之间需保持平衡,即多重分析能力越大反而会导致分析灵敏度的降低。
2.2 液滴微流控技术
采用液滴微流控技术可将单个细胞封装在小的液滴内以分离和研究细胞表面膜蛋白组及其分泌蛋白组。与其他方法不同的是,单细胞被封装在悬浮于油相中的液滴中,细胞空间的隔离有效避免了蛋白组的扩散
[26]。此外,水相确保了培养细胞的正常生理条件,而常用的氟油由于具有较高溶氧量则更利于细胞的培养
[27]。因此,基于液滴的微流控技术在单细胞蛋白组学分析的报道层出不穷。

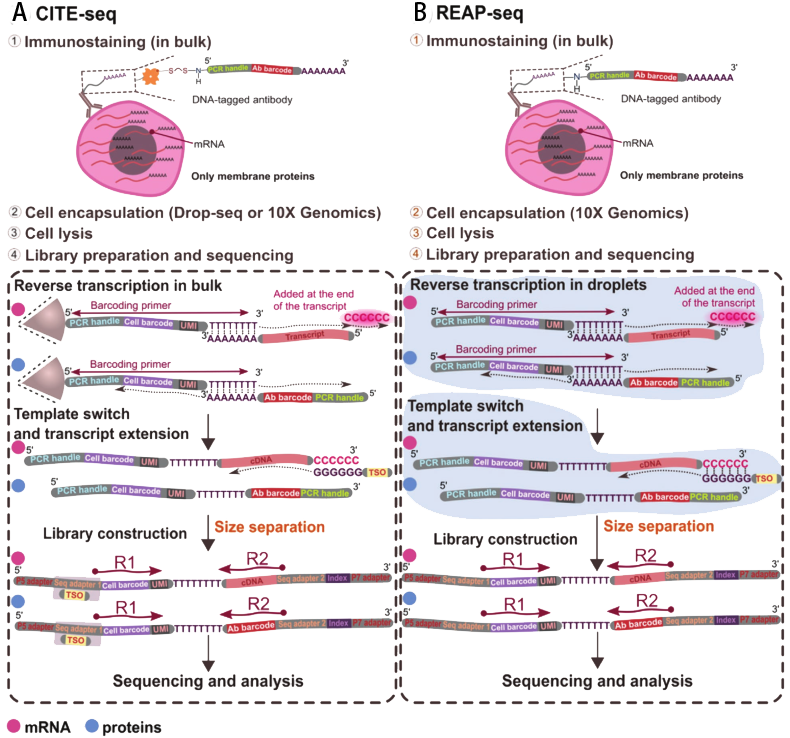
 图3 | A、利用测序对转录组和表位进行细胞索引(CITE-seq);B、RNA表达和蛋白测序分析(REAP-seq)[28], R1: read 1. R2: read 2。
图3 | A、利用测序对转录组和表位进行细胞索引(CITE-seq);B、RNA表达和蛋白测序分析(REAP-seq)[28], R1: read 1. R2: read 2。
Stoeckius等人介绍了一种基于液滴微流控技术,通过测序对转录组和表位进行细胞索引(cell indexing of transcriptomes and epitopes by sequencing, CITE-seq)的方法
[29]。其操作流程如图3A所示,首先利用生物素和链霉亲和素将特异性抗体与寡核苷酸链(包括PCR handle、Ab barcode和捕获DNA序列,其中Ab为抗体,捕获序列能和beads上的序列互补配对)连接;随后,利用传统的流式细胞术用DNA标记的特异性抗体对细胞进行免疫染色;然后采用液滴微流控技术将单细胞、带有条形码的beads及试剂共同封装在液滴中;通过细胞裂解并还原二硫键将寡核苷酸链与特异性抗体断开,细胞中的mRNA序列和标记特异性抗体的DNA序列与beads上的条形码互补配对;随后,mRNA序列和标记特异性抗体的DNA序列利用逆转录同时通过延伸杂交形成互补链;然后,通过PCR扩增对转录组和蛋白组衍生物进行分离以确保文库的相对比例可分别调整;最后,对这两个文库进行测序,并在分析过程中对单细胞蛋白组学和转录组学数据进行分组研究。同年,Peterson等人也提出了RNA表达和蛋白测序分析(RNA expression and protein sequencing, REAP-seq)(图3B所示)
[30]。这种方法与CITE-seq非常相似,但两者的不同点在于寡核苷酸与抗体结合方式由胺类代替原来的生物素和链霉亲和素。这一区别也决定了寡核苷酸与抗体是否能断开。以上这两种技术都适用于单细胞转录组分析的所有液滴微流控技术,然而,其局限性在于只能对细胞表面膜蛋白组进行测定分析。
图4 | Abseq[28], R1: read 1. R2: read 2.
除此之外,Abate 课题组也设计出了Abseq
[31]。这种方法与CITE-seq和REAP-seq相比有些许相同之处,如:用捕获DNA序列标记抗体,且在微流控封装之前用经DNA序列标记的抗体免疫染色细胞,随后对扩增的文库进行测序和数据分析。然而,此法也有不少差异。具体如下:在Abseq中,液滴微流控处理总共三个操作过程(即三个芯片)。首先,利用微流控芯片分别生成两种液滴:一种是单细胞液滴,另一种是条形码引物液滴;其中,单细胞液滴封装DNA标记抗体(利用异双功能交联剂将抗体和寡核苷酸链,寡核苷酸链是由PCR handle、UMI、抗体条码和捕获序列组成)免疫染色的细胞和蛋白酶(用于细胞裂解),条形码引物液滴封装一个DNA序列、PCR试剂及引物混合物,然后通过PCR扩增以实现条形码扩增(每个条形码包含细胞条形码和捕获序列组成);然后,在第三个芯片中生成含有PCR扩增的液滴并与前两个芯片产生的液滴按1:1:1的数量混合;在其混合后每个液滴(非常大且不稳定)被分成四个相等的液滴以进行热循环和PCR扩增;Abseq的优点是在于蛋白酶K裂解细胞后使其失活以免后续细胞裂解物抑制PCR反应。这种方法只适用于单细胞表面膜蛋白组分析,而不适用于mRNA分析。
液滴微流控技术具有独特的优势,一方面可以将单细胞限制在液滴内通过测序的方式对细胞表面膜蛋白组进行分析,另一方面也可以基于荧光液滴微流控技术对单细胞分泌蛋白进行测量以此降低成本。迄今为止,已开发了许多基于荧光的液滴微流控技术用于单细胞分泌蛋白组的工具。通常情况下,将单细胞与捕获结构共同封装在液滴中进行细胞培养,细胞分泌的蛋白后会被捕获结构所捕获
[5]。捕获结构一般分为两部分:一部分(特异性抗体或适配体)用于与细胞分泌蛋白特异性结合,另一部分被固定在载体上(如珠子、细胞表面)。
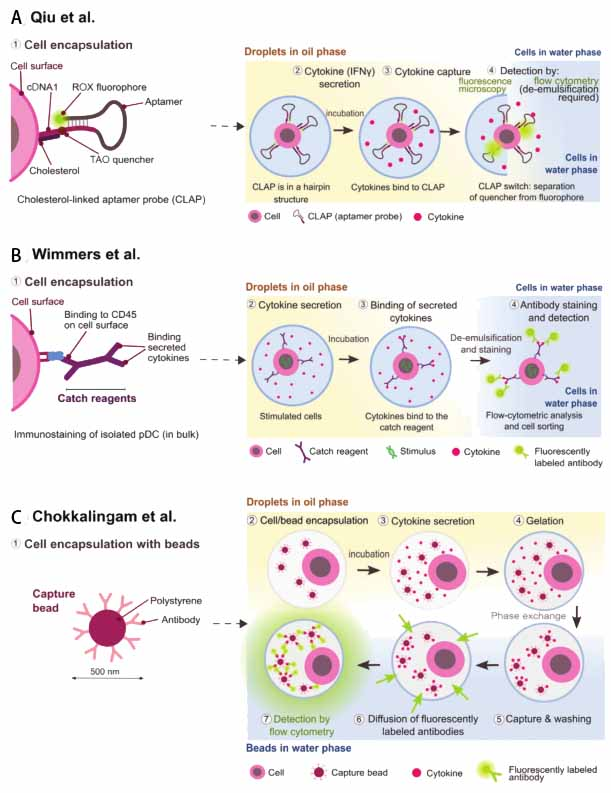
Qiu等人通过直接在细胞膜表面锚定适配体用于捕获细胞分泌蛋白,其优点是所有的操作都是在液滴中进行的,从而能随着时间变化监测细胞分泌蛋白的产生
[32](图5A所示)。其原理如下:首先,通过胆固醇将配体探针与细胞表面的磷脂层连接,而适配体探针两端分别用荧光团和猝灭剂标记;随后,通过液滴微流控技术将带有配体的细胞封装在液滴内。在没有细胞分泌蛋白存在下,配体自杂交形成发夹结构,使荧光团和猝灭剂保持在很近的距离,从而导致荧光的猝灭;当捕获细胞分泌蛋白时,适配体探针转变为一种特定的三级结构,荧光团和猝灭剂被分开,从而导致荧光信号的增强。
Wimmers等人利用锚定在细胞表面的双功能结构抗体捕获细胞分泌蛋白
[33](图5B所示)。在这种情况下,利用液滴微流控技术将锚定抗体的细胞与相应试剂封装,经培养后,细胞产生的分泌蛋白被细胞表面锚定的双功能结构抗体捕获;待破乳后,引入的荧光标记抗体会与细胞表面所捕获的分泌蛋白结合完成分析检测。
此外,也有文献报道通过将捕获细胞分泌蛋白的抗体固定在聚苯乙烯珠上完成分泌蛋白的捕获和分析检测
[34]。具体操作如图5C所示,首先,利用液滴微流控技术将单细胞和分泌蛋白捕获珠共同封装在单分散的琼脂糖液滴中;经封装和孵育,细胞分泌蛋白与聚苯乙烯捕获珠上的抗体结合,并实现琼脂糖液滴的固化;破乳后,获得的琼脂糖珠用荧光标记的抗体染色并通过流式细胞术检测分泌蛋白。
 图5 | 基于液滴微流控技术用于单细胞蛋白组的分析研究。A、细胞膜锚定适配体探针用于捕获分泌蛋白;B、细胞膜锚定抗体用于捕获分泌蛋白;C、抗体标记的捕获珠用于捕获分泌蛋白[28]。
图5 | 基于液滴微流控技术用于单细胞蛋白组的分析研究。A、细胞膜锚定适配体探针用于捕获分泌蛋白;B、细胞膜锚定抗体用于捕获分泌蛋白;C、抗体标记的捕获珠用于捕获分泌蛋白[28]。
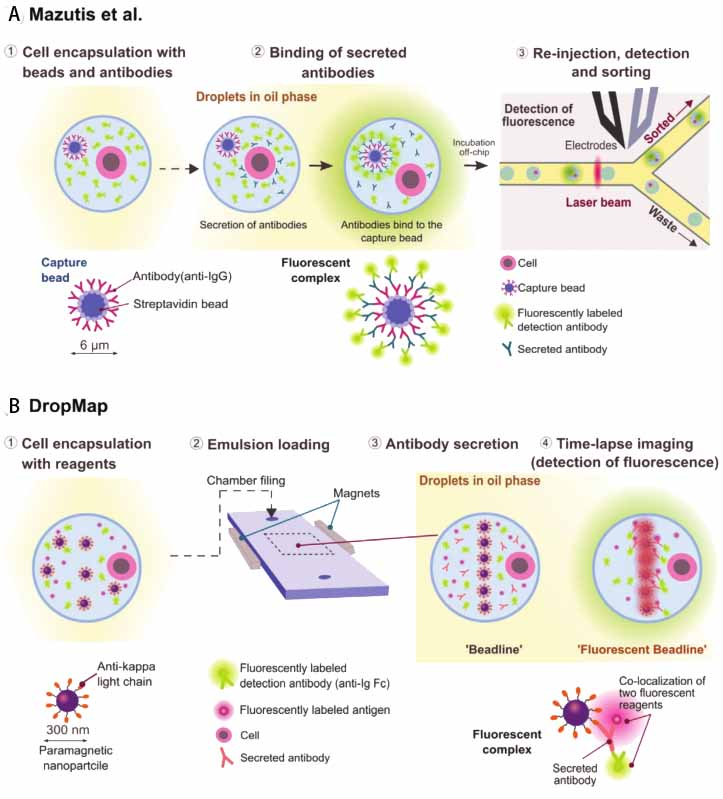
基于液滴微流控技术用于分泌抗体的免疫细胞研究也有较多报道。如Mazutis等利用捕获珠表面的荧光信号对抗体分泌细胞进行分类
[35]。具体流程如图6A所示,首先将单细胞、涂有Anti-IgG抗体的捕获珠和荧光标记的探针一起封装在液滴中;经芯片外培养后,细胞分泌感兴趣的抗体与被捕获珠所捕获;随后,荧光标记的探针与捕获的抗体结合从而定位在捕获珠表面;最后,将乳液重新注入芯片中,并通过捕获珠上局部荧光信号用于高通量筛选抗体分泌细胞。
Eyer等人通过DropMap (droplet-based microfluidic technology)研究单细胞分泌抗体结合特定抗原随时间的变化(图6B所示)。其原理如下:将单细胞、1300个涂有捕获分子的磁纳米颗粒、荧光标记的检测抗体与荧光标记的抗原一起包封在液滴内。随后,将液滴固定在观察室中,在磁力的作用下形成2D液滴阵列结构,并用荧光显微镜进行成像观察;单细胞分泌的抗体与捕获珠结合,并通过与荧光标记的检测抗体结合来显现;此时,施加的磁场会在每个液滴中诱导形成细长、容易观察的纳米颗粒聚集体即珠线;单细胞抗体分泌率可通过标记抗体的荧光强度来观察,而抗体对抗原的亲和力则通过标记抗原的荧光强度来测定。

 图6 | 不同液滴微流控技术在单细胞分泌抗体上的应用有研究。A、 分泌抗体细胞的筛选,B、采用DropMap用于抗体分泌和抗体对特异性抗原的亲和性研究[28]。
图6 | 不同液滴微流控技术在单细胞分泌抗体上的应用有研究。A、 分泌抗体细胞的筛选,B、采用DropMap用于抗体分泌和抗体对特异性抗原的亲和性研究[28]。