实验目的:
本实验方案通过利用微滴/微球制备仪,以Drop-Surf微滴生成油为油相,以5%壳聚糖为水相制备高单分散的微滴,并与接收液油相中的戊二醛发生Schiff碱反应实现微滴的固化。最终获得具有极高的单分散性的壳聚糖微球(CV<5%)。
引言:
壳聚糖是一种功能线性聚合物,是由甲壳素部分去乙酰化而得[1-3]。因其来源广泛、无毒、价格低廉、良好的生物相容性和可降解而备受关注。近年来,壳聚糖作为一种新型功能材料,以纤维、膜、微球和胶囊等形式在蛋白吸附分离、催化剂载体、酶的固定化、重金属吸附和药物释放等方面具有很大的应用潜力[2]。此外,壳聚糖在每个C6原子单元上都有一个游离的氨基,这使得壳聚糖可以与醛基发生Schiff碱反应,且在这一反应过程中生成的C=N键发生n-π*跃迁产生自发荧光[2]。而这种荧光恰恰可以应用于血液循环追踪、细胞外基质表征、体内细胞成像等领域。因此,壳聚糖在生物、医药、化学和环境等领域都有良好的应用前景。
壳聚糖微球粒径的均一度控制对其在生物、医药和催化等领域的成功应用至关重要。目前制备壳聚糖微球的方法有乳化固化、简单凝聚、复合凝聚和膜乳化等[2,4]。虽然这些技术完全可行,但也存在着很大的缺点,如产率不稳定、程序复杂、粒径分布不均和重复性差等。因此,开发一种可重复、粒径及均匀度可控的壳聚糖微球制备技术是其成功应用的必要条件。FluidicLab微滴制备平台运用液滴微流控技术,通过微滴/微球制备仪制备高度均一的壳聚糖微滴,再与戊二醛发生Schiff碱反应实现微滴的固化,最终得到壳聚糖微球。该法操作简便,样品利用率高,制备得到的微球单分散性高(CV<5%),具有较好重复性。
实验材料:
|
试剂
|
|
| 破乳剂(Drop-Surf) | |
|
壳聚糖(Drop-Surf) |
|
|
冰乙酸(Macklin, A801295-500 mL) |
|
|
戊二醛(50%, Aladdin, G105905-500 mL) |
|
|
|
|
|
耗材 |
15 mL离心管(Falcon 15 mL REF 352097)若干 |
|
1.5 mL离心管若干 |
|
|
内/外径0.25 /1.6 mm PEEK管及所需接头 |
|
|
10 mL和20 mL透明玻璃瓶若干 |
|
|
0.22 μm针式过滤器(PTFE材质)若干 |
|
|
10 mL注射器若干 |
|
|
|
|
|
芯片夹具 |
|
|
|
|
|
设备 |
|
|
辅助设备
|
电脑(Win10 以上系统) |
|
高速离心机(湖南湘仪, H1850) |
|
|
普通光学显微镜(用于测微球粒径) |
实验步骤:
1.试剂配制:
|a、5%(wt%)壳聚糖水溶液:
将0.5 g壳聚糖加入到约9.3 mL的超纯水中,并加入200 μL (约0.2 g)冰乙酸辅助溶解,振荡放置于85 ℃的鼓风干燥箱中加热溶解;待完全溶解后用0.22 μm的针式过滤器过滤备用。
|b、1%戊二醛油相溶液:
取490 μL微滴生成油,加入体积为10 μL的50%戊二醛,振荡均匀备用。
2.微滴制备:
|a、微滴/微球制备仪的安装连接
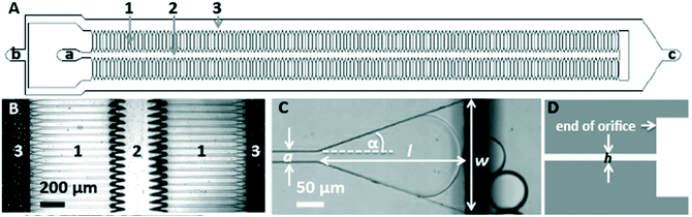
微滴/微球制备仪安装连接参考《微滴/微球制备仪使用手册V.1.0》中“2. 微滴/微球制备仪的安装连接”的部分;其连接如下(步骤③-⑦连接效果如下图所示):
① 用气管依次连接“空气压缩机”--“气源处理装置”--“微滴/微球制备仪”;
② 将微滴/微球制备仪分别与电源、电脑的连接;
③ 用气管分别将A0(压力输出通道一)和A1(油相15 mL储液池),B0(压力输出通道二)和B1(水相1.5 mL储液池)连接;
④ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A1(油相15 mL储液池)和A2(通道一流量传感器),B1(水相1.5 mL储液池)和B2(通道二流量传感器)连接;
⑤ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A2(通道一流量传感器)和A3(PDMS芯片的油相入口),B2(通道二流量传感器)和B3(PDMS芯片的水相入口)连接;
⑥ C为标准PDMS芯片和夹具的组合,芯片和夹具的入口通过硅胶塞密封;
⑦ 用PEEK管(内/外径 0.25 mm/1.6 mm)将芯片出口D处生成的乳液导出。
|b、FluidicLabSuite软件的安装和设备的添加:
FluidicLabSuite软件的安装参考《微滴/微球制备仪使用手册V.1.0》中“3.1 FluidicLabSuite软件的安装”的部分;
|c、壳聚糖微液滴的制备:
具体操作步骤如下(参考视频“微流控应用:微滴生成仪制备壳聚糖微球”):
https://www.fluidiclab.com/chitosan-microspheres/
① 分别在15 mL油相储液池(通道一)和1.5 mL水相储液池(通道二)中依次加入5 mL微滴生成油和1 mL 5%的壳聚糖水溶液;
② FluidicLabSuite软件的设备添加参考《微滴/微球制备仪使用手册V.1.0》中“3.2 FluidicLabSuite软件的设备添加”的部分(相机和流量传感器仅需添加一次);
③ 打开空气压缩机和气源处理装置开关;
④ 在乳液出口端放置离心管接收微滴稳定前的废液;
⑤ 在电脑端设置通道一压力(油相,如150 mbar)和通道二压力(水相,如900 mbar,水相黏度大,流阻大,压力更大)排出管路和芯片中的空气;
⑥ 待管路和芯片中完全填充液体后(空气被完全排出);将整个系统由压力控制切换到流速控制,并设置通道一(油相)和通道二(水相)流速分别为20和5 μL/min;
⑦ 调整反馈值(Feedback)快速达到设定流速,并实现流速的稳定输出;
⑧ 用疏水培养皿接收一滴乳液,并在普通光学显微镜下观察其微滴的均匀性;
⑨ 待微滴生成均匀后,即可开始接收至装有1%戊二醛油相溶液的1.5 mL离心管中;
⑩ 20 min后停止收集,密封于离心管中,轻微振荡加快微滴固化,随后静置一段时间。
3.壳聚糖微球的破乳清洗:
具体操作步骤如下(参考视频“微流控应用:微滴生成仪制备壳聚糖微球”):
https://www.fluidiclab.com/chitosan-microspheres/
① 取出1.5 mL离心管底部微滴生成油;
② 按V球:V破=1:2 加入破乳剂,振荡破乳;
③ 2500 rpm离心处理1 min,并取出底部破乳剂;
④ 重复上述②和③操作;
⑤ 最终得到固化后的壳聚糖微球。
4、微滴/微球制备仪清洗:
微滴生成仪每次使用完必须清洗管路、流量传感器和芯片。具体操作详见“微滴/微球制备仪操作指导卡”。
结果与讨论:
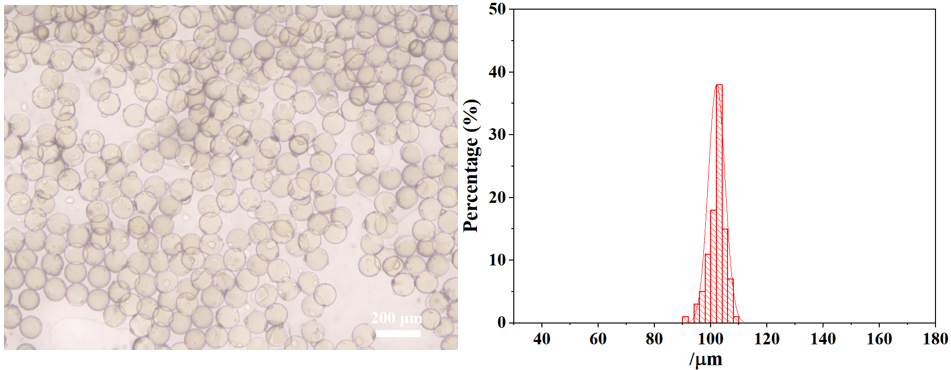
刚接收的微滴平均粒径为107.53 μm,具有极高的单分散性(变异系数:CV=2.14%)。其显微镜图和粒径分布如下图所示:
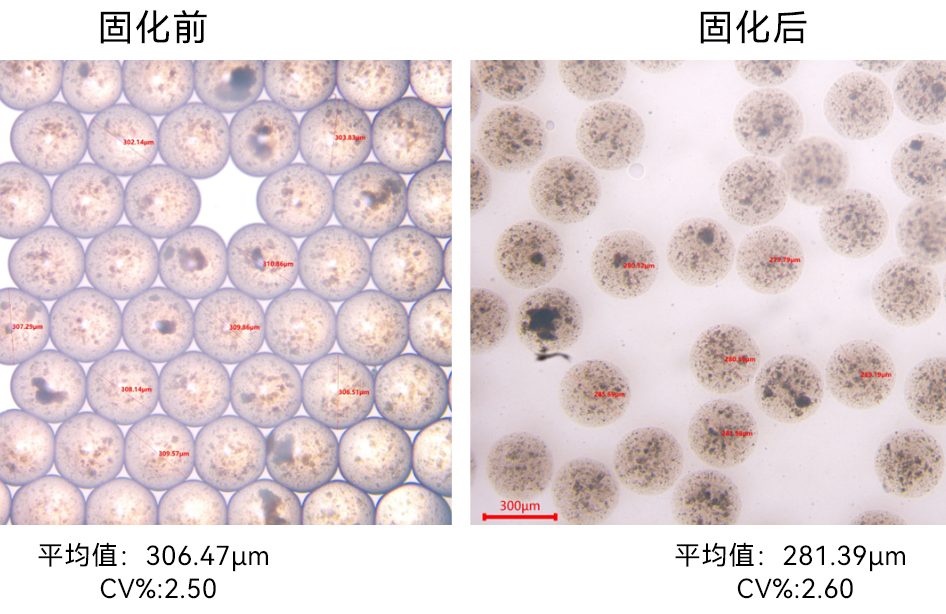
通过与戊二醛发生Schiff碱反应实现微滴的固化,最终获得的壳聚糖微球平均粒径为101.67 μm,具有极高的单分散性(变异系数:CV=2.53%)。其显微镜图和粒径分布如下图所示:
参考文献:
[1] Zhao H., et al. A novel microfluidic approach for monodispersed chitosan microspheres with enhanced autofluorescence, Chem. Eng. J., 215–216, 784-790 (2013).
[2] Xu, J.H., et al. A Novel Microfluidic Approach for Monodispersed Chitosan Microspheres with Controllable Structures. Adv. Healthcare Mater., 1, 106-111 (2012).
[3] Zhu Y., et al. Microfluidic synthesis of thiourea modified chitosan microsphere of high specific surface area for heavy metal wastewater treatment, Chin. Chem. Lett.,28, 633-641 (2016).
[4] Xu, J.H., et al. Preparation of monodispersed chitosan microspheres and in situ encapsulation of BSA in a co-axial microfluidic device. Biomed Microdevices, 11, 243–249 (2009).