实验目的:
本实验方案利用微滴/微球制备仪,以Drop-Surf微滴生成油为油相,以含有螯合物Ca-EDTA和海藻酸钠的溶液为水相制备微液滴,将其接收至含有乙酸的油相中固化制备得到高单分散的海藻酸钠凝胶微球(CV<5%)。
引言:
水凝胶是一类重要的软性材料,被广泛应用于药物研究、药物递送、组织工程和食品科学等领域。在众多制备水凝胶的天然高分材料中,海藻酸盐作为一种天然多糖,由于其低毒性、温和的离子交联条件、良好的生物相容性和生物可降解性等优点,在生物医学领域得到极大的关注[1]。
微米大小的海藻酸盐微凝胶球在药物研究、组织工程和再生医学中常被用于包裹活细胞。这种微凝胶球将细胞分散在独立的区域内为细胞代谢的研究提供了一种有效的策略[2]。纳升至皮升的微球可作为独立的反应器,用于以定量单细胞的方式监测、培养或操纵细胞。由于海藻酸盐与细胞外基质具有内在的结构相似性,这使得营养物质和氧气有效的被包裹的细胞摄取[3]。因此,海藻酸盐凝胶微球已被广泛用于哺乳动物细胞培养和组织工程的模型系统,即器管(或组织)衰竭时的器管(或组织)替代品[4]。此外,由于细胞间的距离和结构排列对细胞的性质和功能有显著的影响,因此,微球大小和尺寸分布的精确控制至关重要[5]。
采用液滴微流控技术可以生产形状精确可控和粒径均一的海藻酸盐凝胶微球。通常,海藻酸盐溶液在液滴微流控芯片中乳化并分散在油相中,随后与Ca2+进行交联。而这种快速的交联反应很可能导致液滴生成粒径不均和微流控芯片的堵塞。因此,采用液滴微流控制备时需将液滴生成与凝胶化反应分开。例如,张等通过将CaCO3纳米颗粒分散于海藻酸盐水溶液中,然后将生成后的液滴暴露在酸性条件下,导致CaCO3的溶解释放Ca2+,并使其与海藻酸盐交联凝胶化[6]。然而,由于CaCO3呈颗粒状,pH降低导致Ca2+的释放分布不均,进而使得离子交联均匀性较差。此外,纳米颗粒的团聚也会导致微流控芯片流道的堵塞。
基于以上问题,Fluidiclab微滴制备平台借鉴Utech等人研究运用液滴微流控技术[7],以Drop-Surf微滴生成油为油相,以含有螯合物Ca-EDTA和海藻酸钠的溶液为水相制备微液滴,将其接收至含有乙酸的液油相中固化制备得到高单分散的海藻酸钠凝胶微球(CV<5%)。其主要原理如下图所示,H+和EDTA结合释放出Ca2+,Ca2+和海藻酸盐交联发生凝胶反应,最终得到海藻酸盐微球。该法操作简便,样品利用率高,制备得到的微球单分散性高,具有较好重复性。
海藻酸钠凝胶化机理图
实验材料:
| 试剂 | 微滴生成油 (Drop-Surf,FluidicLab)
破乳剂 (Drop-Surf,FluidicLab) 海藻酸钠 (FluidicLab) 冰乙酸 (Macklin, A801295-500 mL) 无水氯化钙 (General-Reagent, P1902809) 0.5 M EDTA (Macklin, E885215-1L) 氢氧化钠 (Macklin, S817971-500 G) |
| 耗材 | 15 mL离心管(Falcon 15 mL REF 352097)若干
1.5 mL离心管若干 内/外径0.25 /1.6 mm PEEK管及所需接头 10 mL和20 mL透明玻璃瓶若干 0.22 μm针式过滤器(PTFE材质)若干 10 mL注射器若干 |
| 芯片夹具 | PDMS-FF-100 μm 芯片(FluidicLab)
PDMS标准芯片夹具 |
| 设备 | Fluidiclab微滴/微球制备仪(两通道) |
| 辅助设备 | 高速离心机(湖南湘仪, H1850)
梅特勒托利多pH计(标准版)、普通光学显微镜(用于测微球粒径) |
实验步骤:
一、 试剂配制:
1、2 M CaCl2 溶液配制:
取2.2197 g的无水CaCl2 (MCaCl2=110.984 g/moL)加入超纯水振荡溶解,最终定容至10 mL备用。
2、 2 % (wt%)海藻酸钠溶液配制:
取0.2 g的海藻酸钠固体粉末加入超纯水超声振荡,60 ℃加热辅助溶解,最终定容至10 mL备用。
3、 2 M NaOH溶液配制
取1.6 g的NaOH(MNaOH=176.17 g/moL)加入超纯水振荡溶解,最终定容至20 mL备用。
4、 240 mM Ca-EDTA溶液(pH=7.2)配制
分别取1.2 mL的2 M CaCl2,4.8 mL的0.5 M EDTA,加入2 M NaOH调节pH至7.2,最终定容至10 mL备用。
【注】下表加入体积供参考,实际加入量以pH值变化为准。
5、水相溶液配制 (1% 海藻酸钠,120 mM Ca-EDTA)
取等体积240 mM Ca-EDTA溶液与2%海藻酸钠溶液振荡均匀得到水相溶液,用0.22 μm针式过滤器过滤备用。
6、 1% 醋酸油相溶液配制 (pH=4.8)
取500 μL微滴生成油,加入体积为5 μL的冰乙酸,振荡均匀备用。
二、 微滴制备:
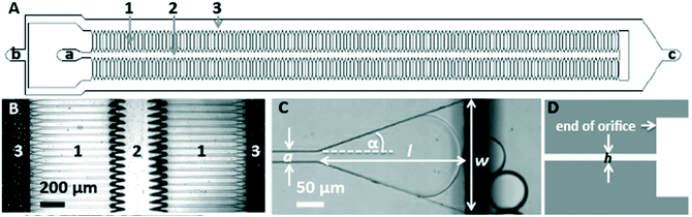
1. 微滴/微球制备仪的安装连接
微滴/微球制备仪安装连接参考《微滴/微球制备仪使用手册V.1.0》中“2. 微滴/微球制备仪的安装连接”的部分;其连接如下(步骤③-⑦连接效果如下图所示):
① 用气管依次连接“空气压缩机”--“气源处理装置”--“微滴/微球制备仪”;
② 将微滴/微球制备仪分别与电源、电脑的连接;
③ 用气管分别将A0(压力输出通道一)和A1(油相15 mL储液池),B0(压力输出通道二)和B1(水相1.5 mL储液池)连接;
④ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A1(油相15 mL储液池)和A2(通道一流量传感器),B1(水相1.5 mL储液池)和B2(通道二流量传感器)连接;
⑤ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A2(通道一流量传感器)和A3(PDMS芯片的油相入口),B2(通道二流量传感器)和B3(PDMS芯片的水相入口)连接;
⑥ C为标准PDMS芯片和夹具的组合,芯片和夹具的入口通过硅胶塞密封;
⑦ 用PEEK管(内/外径 0.25 mm/1.6 mm)将芯片出口D处生成的乳液导出。
2. FluidicLabSuite软件的安装和设备的添加:
FluidicLabSuite软件的安装参考《微滴/微球制备仪使用手册V.1.0》中“3.1 FluidicLabSuite软件的安装”的部分;
3. 海藻酸钠微液滴的制备:
具体操作步骤如下:
① 分别在15 mL油相储液池(通道一)和1.5 mL水相储液池(通道二)中依次加入5 mL微滴生成油和1 mL 配制好的水相溶液;
② FluidicLabSuite软件的设备添加参考《微滴/微球制备仪使用手册V.1.0》中“3.2 FluidicLabSuite软件的设备添加”的部分(相机和流量传感器仅需添加一次);
③ 打开空气压缩机和气源处理装置开关;
④ 在乳液出口端放置离心管接收微滴稳定前的废液;
⑤ 在电脑端设置通道一压力(油相,如150 mbar)和通道二压力(水相,如900 mbar,水相黏度大,流阻大,压力更大)排出管路和芯片中的空气;
⑥ 待管路和芯片中完全填充液体后(空气被完全排出);将整个系统由压力控制切换到流速控制,并设置通道一(油相)和通道二(水相)流速分别为15和8 μL/min;
⑦ 调整反馈值(Feedback)快速达到设定流速,并实现流速的稳定输出;
⑧ 用疏水培养皿接收一滴乳液,并在普通光学显微镜下观察其微滴的均匀性;
⑨ 待微滴生成均匀后,即可开始接收至装有1%醋酸油相溶液的1.5 mL离心管中;
⑩ 20 min后停止收集,密封于离心管中,轻微振荡加快微滴固化,随后静置一段时间。
三. 海藻酸钠微球的破乳清洗:
具体操作步骤如下:
① 取出1.5 mL离心管底部微滴生成油;
② 按V球:V破=1:2 加入破乳剂,振荡破乳;
③ 2500 rpm离心处理1 min,并取出底部破乳剂;
④ 重复上述②和③操作;
⑤ 最终得到固化后的海藻酸钠微球,分散在PBS缓冲液中。
四、 微滴/微球制备仪清洗:
微滴生成仪每次使用完必须清洗管路、流量传感器和芯片。
具体操作详见“微滴/微球制备仪操作指导卡”。
结果与讨论:
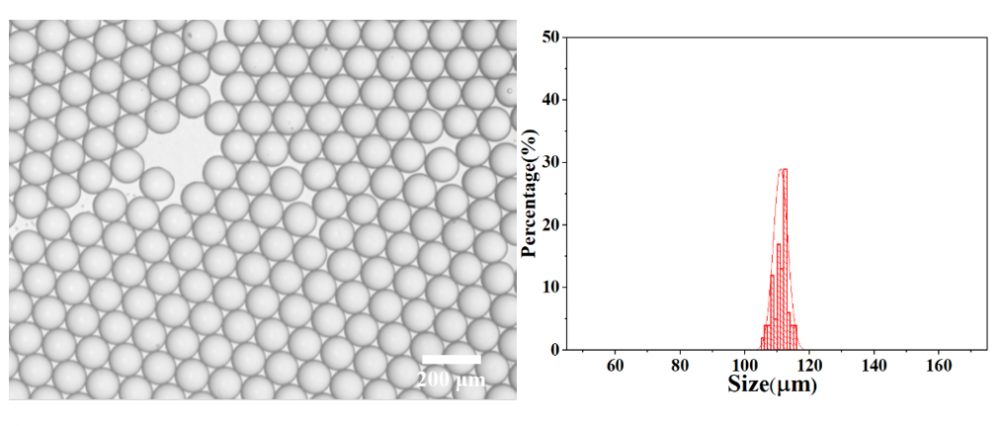
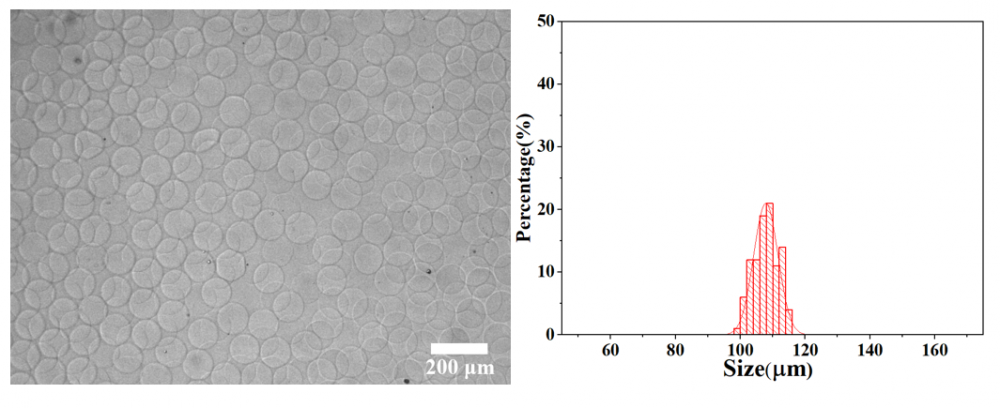
刚接收的微滴平均粒径为111.04 μm,具有极高的单分散性(变异系数:CV=2.01%)。其显微镜图和粒径分布如下图所示:
参考文献:
[1] Ching S. H., et al. Alginate gel particles–a review of production techniques and physical properties, Crit. Rev. Food Sci., 57, 1133-1152 (2015).
[2] Wang H , et al. The use of micro- and nanospheres as functional components for bone tissue regeneration , Tissue Eng. Part B Rev., 18, 24-39 (2012).
[3] Wan. J, Microfluidic-Based Synthesis of hydrogel particles for cell microencapsulation and cell-based drug delivery, Polymers, 4, 1084-1108 (2012).
[4] Rowley J.A., et al. Alginate hydrogels as synthetic extracellular matrix materials., Biomaterials, 20 , 45-53 (1999).
[5] Bhatia, S. N., et al. Effect of cell–cell interactions in preservation of cellular phenotype: cocultivation of hepatocytes and nonparenchymal cells. FASEB J. 13, 1883–1900 (1999).
[6] Zhang H., et al. Exploring microfluidic routes to microgels of biological polymers, Macromol. Rapid Comm.,28, 527-538 (2007).
[7] Utech S., et al. Microfluidic generation of monodisperse, structurally homogeneous alginate microgels for cell encapsulation and 3D cell culture,Adv. Heal. Mater., 4, 1628-1633 (2015).